Graduate Program in Dentistry of PUC Minas (PPGO PUC Minas)
Raiane Machado Maia (1)
Ana Luiza Cabral de Ávila Andrade (2)
Lílian Dayse Fróes Tavares (3)
Bernardo Quiroga Souki (4)
(1) Master degree student – Graduate Program in Dentistry at PUC Minas
(2) Master degree student Graduate Program in Orthodontics at PUC Minas
(3) Undergraduate student at PUC Minas
(4) Associate Professor of Dentistry – Orthodontic branch at PUC Minas
In the last decades, the dentifrices have been under several developments, with the addition of various active substances in its composition, in order to be more than a breath saver. (Magalhães et al., 2011). Thus, using dentifrices became essential in daily tooth brushing, helping reduce cavity diseases, periodontal diseases, dental calculus, dental hypersensitivity, and halitosis (Cury e Oliveira, 2021; Oliveira et al., 2002).
To control extrinsic pigmentation and to facilitate the removal of the biofilm are the major goals of the dentifrices. Thus, the addition of abrasive components such as hydrated silica, sodium bicarbonate, calcium pyrophosphate, calcium phosphate, tricalcium phosphate, aluminum hydroxide, silicon dioxide, titanium dioxide, zinc citrate, and soluble pyrophosphate is mandatory (Cury e Oliveira, 2021; Oliveira et al., 2002). In the past years, activated charcoal-based products have been offered on the market, with a significant investment in advertisement, with the proposal to perform tooth whitening in a faster and more practical way in comparison to conventional techniques (Brooks et al., 2017). However, there have been inherent limitations of this substance that need to be made widely known by the public.
The abrasiveness of each dentifrice is measured by the RDA (dentin wear index), proposed in 1970 to ensure safety in the continuous use of toothpaste. Healthy enamel has a higher hardness index than most abrasive substances used. On the other hand, enamel subjected to acid challenge and dentin is susceptible to significant wear by more abrasive dentifrices (Cury e Oliveira, 2021).
Among the dentifrices that advocate tooth whitening, most features higher RDA or the presence of anti-tartar additives (such as pyrophosphates and polyphosphates) (Oliveira et al., 2022). Those products may also contain a higher concentration of flavorings and detergents, making them potentially more irritating formulations for the oral mucosa. Another possible adverse effect caused by using specific products not prescribed by dentists is the onset or worsening of dentin hypersensitivity (Cury e Oliveira, 2021; Oliveira et al., 2022).
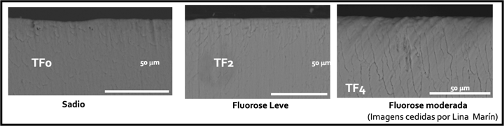
Toothpaste with activated charcoal in its composition has a high abrasive potential. This potential varies according to characteristics such as charcoal’s origin, preparation method, and particle size. At first, using these products can promote an increase in the brightness and reflectance of the enamel, resulting in an appearance reported by many people as “whiter and brighter teeth” (Joiner et al., 2008). Nevertheless, Rodrigues et al. (2019) demonstrated, using optical coherence tomography, that toothbrushing with charcoal-based dentifrices can promote intense wear of tooth enamel. The same was demonstrated by Pertiwi et al. (2017) and Losekann et al. (2020), who concluded that the use of toothpaste containing activated charcoal increases the surface roughness of the tooth enamel, producing morphological changes on the tooth surface.
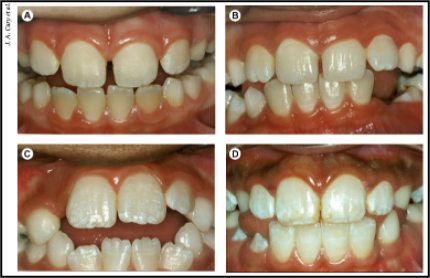
Dionysopoulos et al. (2020), through an in vitro study, investigated the effectiveness of a whitening dentifrice containing charcoal and mouthwash in changing the color of teeth and enamel alterations that can be induced after brushing for 90 days. (Figures 1 to 4). Forty human canines stained with coffee were used and divided into four groups (n = 10) submitted to brushing as follows: Group 1 (control) deionized water; Group 2 regular toothpaste (RDA = 70); Group 3 whitening toothpaste (1% charcoal); Group 4 the same whitening toothpaste in combination with whitening mouthwash (1% charcoal and 0.5% H2O2). Despite the limitations of the study, the authors concluded that charcoal-containing toothpaste had a more significant whitening effect on teeth than regular toothpaste (however, this change may not be perceptible to the human eye), and the use of the mouthwash in combination did not improve the color change. In addition, they found that whitening toothpaste during brushing influenced the surface morphology of the enamel differently, while the mouthwash did not influence these morphological changes. Thus, although whitening dentifrices containing charcoal may offer some change in the color of the teeth, they must be used with care and following the guidelines of a dental surgeon due to the superficial morphological changes that they can induce in the enamel.




In the long term, the damage caused to the teeth will result in darkening and dentin hypersensitivity, resulting from the decrease in the thickness of the enamel and the disclosure of the dentin tissue (de Cerqueira Santos et al., 2022; Rodrigues et al., 2019). The damage caused is directly proportional to the amount of abrasive present in the toothpaste and the time the product has been used; as well as duration, frequency, and force applied during brushing; aggravated by factors that promote enamel loss, such as acid erosion and abrasion injuries.
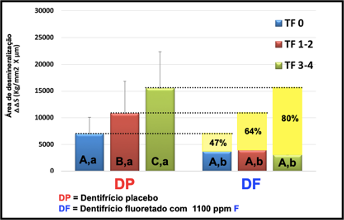
Dentifrices with activated charcoal, rarely report the presence of fluoride in their composition. There are still no studies that prove the actual availability of fluoride in these products, and it is worth noting that charcoal has a great capacity for interaction with fluoride, which suggests that the formulations may have an absence or low concentration of fluoride (Brooks et al., 2017; Losekann et al., 2020; Oliveira et al., 2022). The literature presents indisputable evidence that toothbrushing with fluoride dentifrices in concentrations of at least 1000 ppm F- is one of the factors responsible for the reduction of dental cavities rates (Cury e Oliveira, 2021; Magalhães et al., 2011; Oliveira et al., 2022). Because of this, it is believed that individuals who exclusively use dentifrices with activated charcoal in their formulation are at a higher risk of developing dental cavities.
Additionally, due to its ability to wear teeth, activated charcoal can contribute to the process of cavities development. This is due to its ability to promote cavitations in active white spot lesions (Rocha et al., 2019).
Damage caused by charcoal is not limited to hard tissue. Greenwall et al. (2019) alerted to periodontal aesthetic damage due to the risk of accumulation of charcoal particles in defects and periodontal pockets. In addition, the authors reported that the abrasiveness of the product can be a risk factor for the recession of the gingival margin, which can lead to exposure to dentin, an area of high sensitivity for patients. Cury and Oliveira (2021) and Oliveira et al. (2022) also report the damage that dentifrices containing activated charcoal can cause to the periodontium: the accumulation of charcoal particles in periodontal pockets can change the appearance of tissues and make it difficult to perceive possible gingival bleeding during brushing, an essential sign of inflammation.
Resin materials are also a significant concern related to the increase in roughness caused by dentifrices with activated carbon, as they can change color, brightness, and surface smoothness, in addition to more marked and evident edges (Cury e Oliveira, 2021; Oliveira et al., 2022). Torso et al. (2021) concluded in their study that charcoal-based dentifrices provided more excellent darkening and surface wear of the composite resin compared to conventional toothpaste.
Generally speaking, insufficient scientific evidence substantiates the efficacy and safety of using activated charcoal-based toothpaste (Brooks et al., 2017; de Moura et al., 2022; Orellana-Centeno et al., 2020). Considering the various damages that these products can cause to the tooth structure, there is a need for further clinical studies to have sufficient information about the possible benefits and harms of toothbrushing with charcoal-based products (Monteiro et al., 2020). Dentists should advise their patients to be careful when using charcoal and charcoal-based dentifrices with unproven efficacy and safety claims (Brooks et al., 2017).
References
Brooks JK, Bashirelahi N, Reynolds MA. Charcoal and charcoal-based dentifrices: a literature review. J Am Dent Assoc. 2017;148(9):661-70.
Cury JA, Oliveira MLM. Dentifrícios e enxaguatórios bucais [livro eletrônico]: produtos que podem ser prescritos pelo dentista. 1. ed. Belo Horizonte: Ed dos Autores, 2021. v. 1. 41p.
de Cerqueira Santos MR, Caju GBL, de Oliveira Santos INA, Paes LR, dos Santos Junior VE, de Mendonça Fragoso LS, Romão DA, Bomfim da Silva MA, Porto ICCM, Rodrigues RF. Produtos clareadores dentais contendo carvão ativado são eficazes? Revista Eletrônica Acervo Saúde. 2022;15(6):e10318-e10318.
de Moura JA, de Albuquerque Silva WM, de França T. Perigos do uso de carvão ativado para o clareamento dental. Research, Society and Development. 2022;11(8): e9111830558-e9111830558.
Dionysopoulos D, Papageorgiou S, Malletzidou L, Gerasimidou O, Tolidis K. Effect of novel charcoal-containingwhitening toothpaste and mouthwash on color change and surface morphology of enamel. Journal of Conservative Dentistry: JCD. 2020; 23(6):624-31.
Greenwall LH, Greenwall-Cohen J, Wilson NHF. Charcoal-containing dentifrices.
Br Dent J. 2019; 226:697-700.
Joiner A, Philpotts CJ, Alonso C, Ashcroft AT, Sygrove NJ. A novel optical approach
to achieving tooth whitening. J Dent. 2008; 36: 8-14.
Losekann AP, Zimmer R, Klein-Junior CA, Reston EG, Macedo CLR. Efeitos abrasivos produzidos por um dentifrício à base de carvão. STOMATOS. 2020;26(51):77-83.
Magalhães AC, Moron BM, Comar LP, Buzalaf MAR. Uso racional dos dentifrícios. RGO. Revista Gaúcha de Odontologia (Online). 2011;59(4):615-625.
Monteiro ABO, Andrade JCS, dos SANTOS AF. Influência de cremes dentais clareadores e pó a base de carvão ativado sobre a estrutura dentária: eficácia do clareamento e desgaste-revisão de literatura. Facit Business and Technology Journal. 2020;2(19).
Oliveira, MLM, Rösing CK, Cury JC. Prescrição de produtos de higiene oral e aplicação profissional de fluoretos [livro eletrônico]: manual com perguntas e respostas. Belo Horizonte, MG: Ed. da Autora, 2022.
Orellana-Centeno JE, Morales-Castillo V, Guerrero-Sotelo R. Carbón Activado en
Pastas Dentales: Moda o una Opción en la Limpieza Bucal. Salud y Administración.
2020;7(19):59-63.
Pertiwi UI, Eriwati YK, Irawan B. Surface changes of enamel afer brushing with
charcoal toothpaste. J Phys Conf Series. 2017; 884: 012002.
Rocha MIS, Magalhães MA, Silva CF, Santos Filho PCF, Dietrich L, Martins VM. Avaliação da eficácia e riscos do uso do carvão ativado na odontologia. Revista de Odontologia Contemporânea. 2019;3(1):11-19.
Rodrigues BAL, Melo LSA, Ribeiro RAO, Nascimento ABL, Teixeira HM. Avaliação
através da tomografia por coerência óptica do esmalte dentário após o uso de dentifrícios
clareadores. Rev Odontol UNESP. 2019;48:e20190078.
Torso VH, Fraga MAA, Lopes RM, Aranha ACC, Correr‐Sobrinho L, Correr AB. Charcoal‐based dentifrices: Effect on color stability and surface wear of resin composites. Journal of Esthetic and Restorative Dentistry. 2021;33(5):815-823.