Aline Olívia Ribeiro (1)
Vitória Netto de Albuquerque (2)
Dayane Ferreira Resende (2)
Felipe Martins Vono (1)
Gianfilippo Machado Cornacchia (3)
Elton Gonçalves Zenóbio (4)
Vânia Eloisa de Araújo Silva (4)
1)Discente do curso de Mestrado profissional em implantodontia – PPGO PUC Minas
2) Discentes do curso de Mestrado Acadêmico em Clínicas odontológicas – PPGO PUC Minas
3) Discentes do curso de Doutorado – PPGO PUC Minas
4) Docente do PPGO PUC Minas
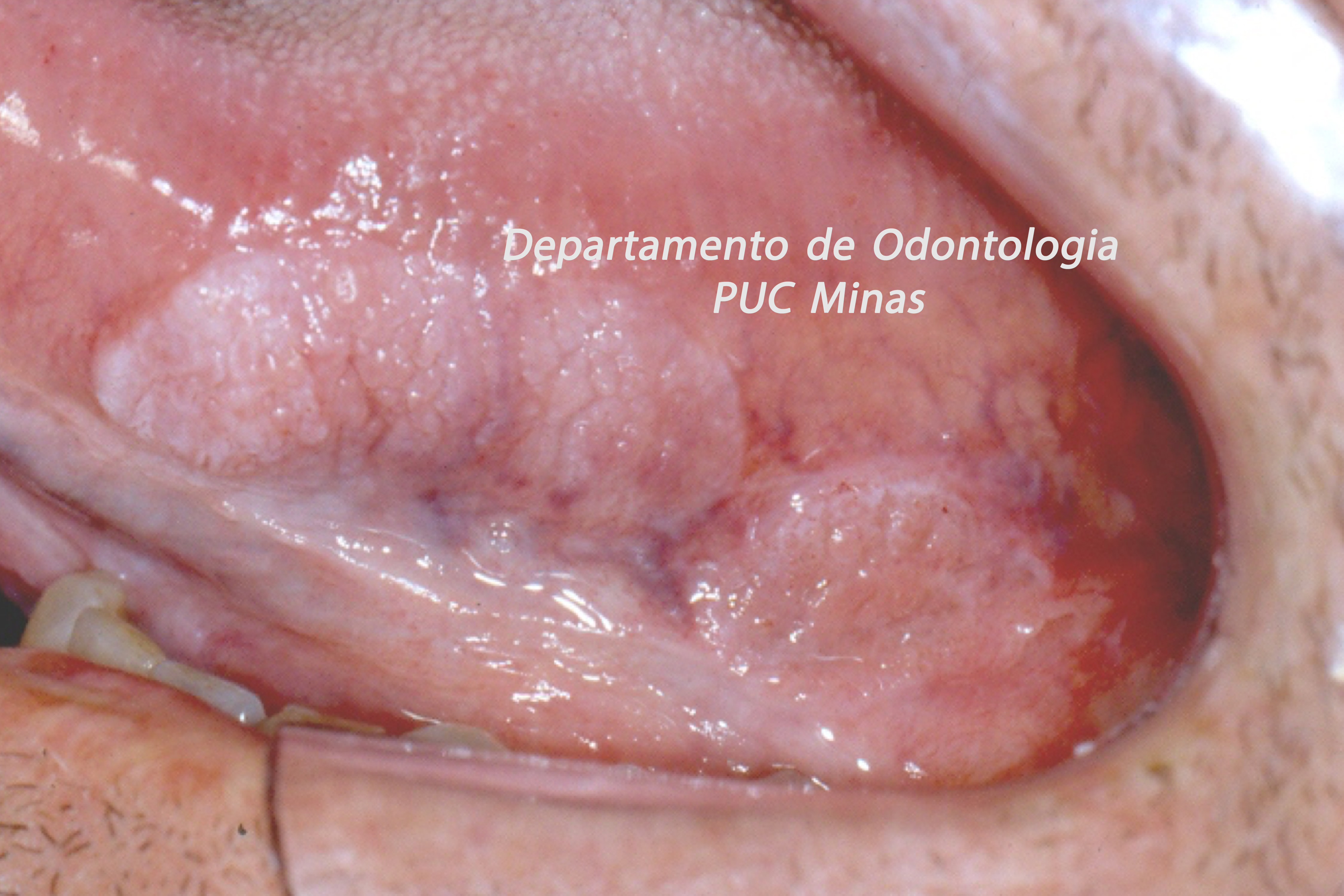
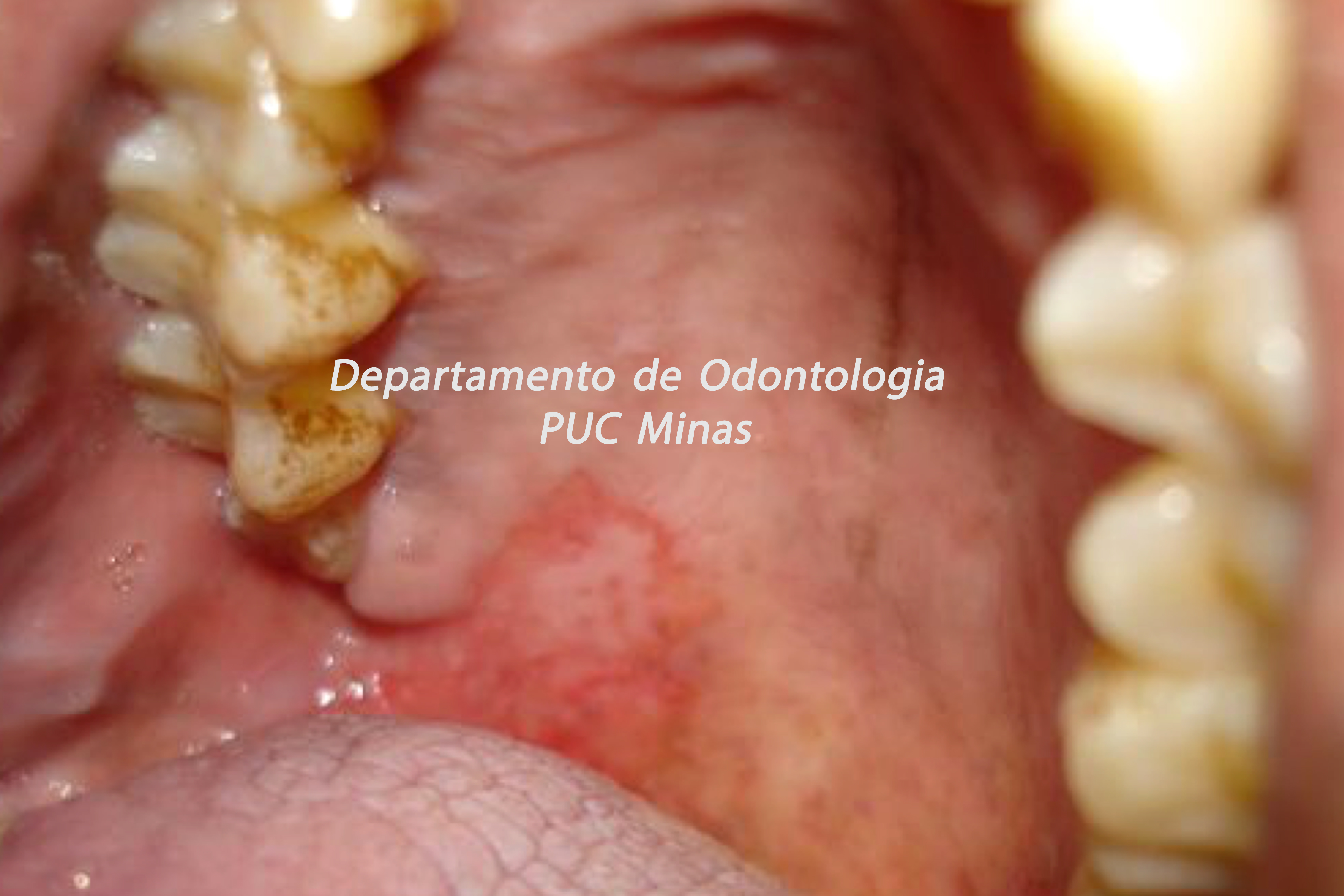
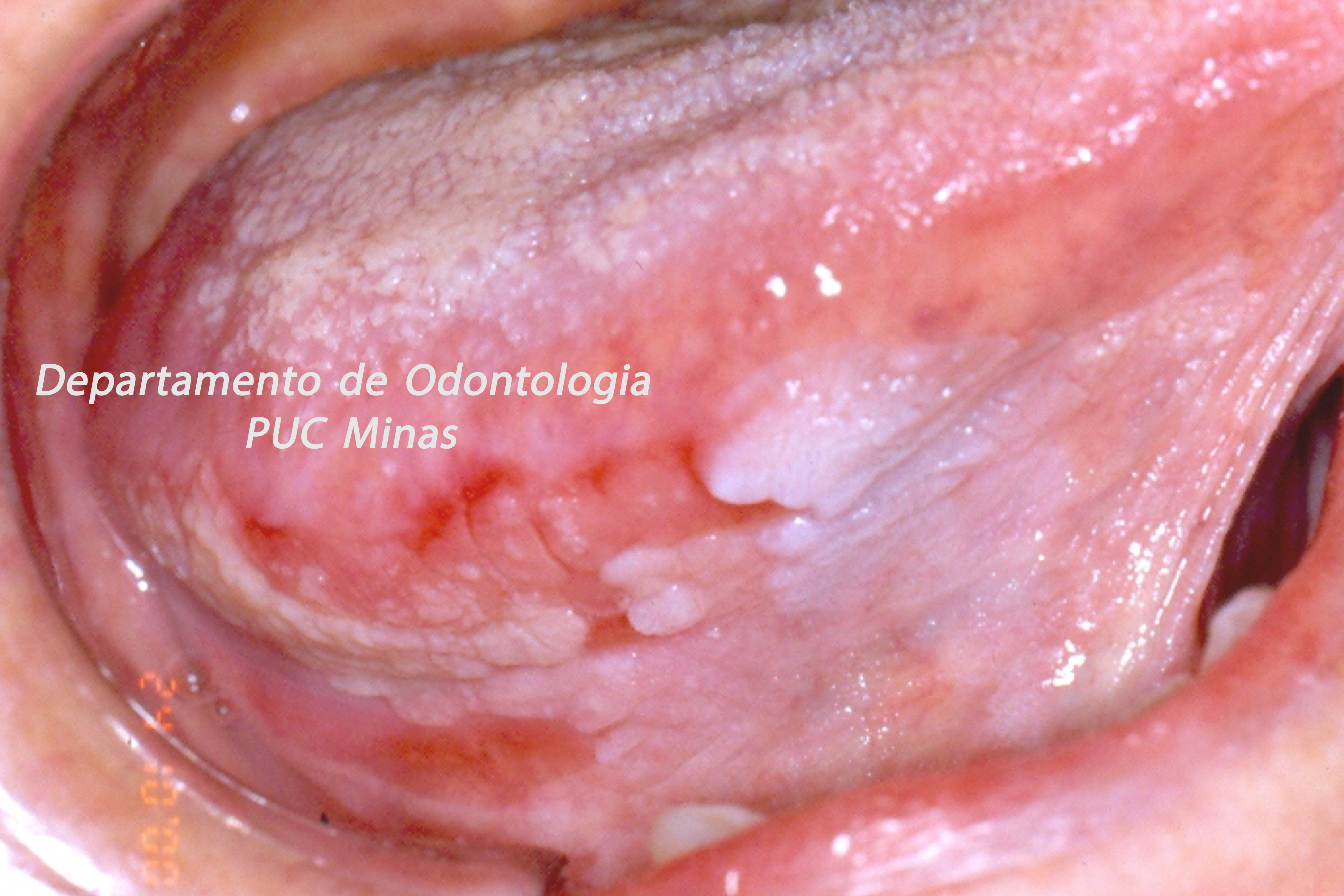
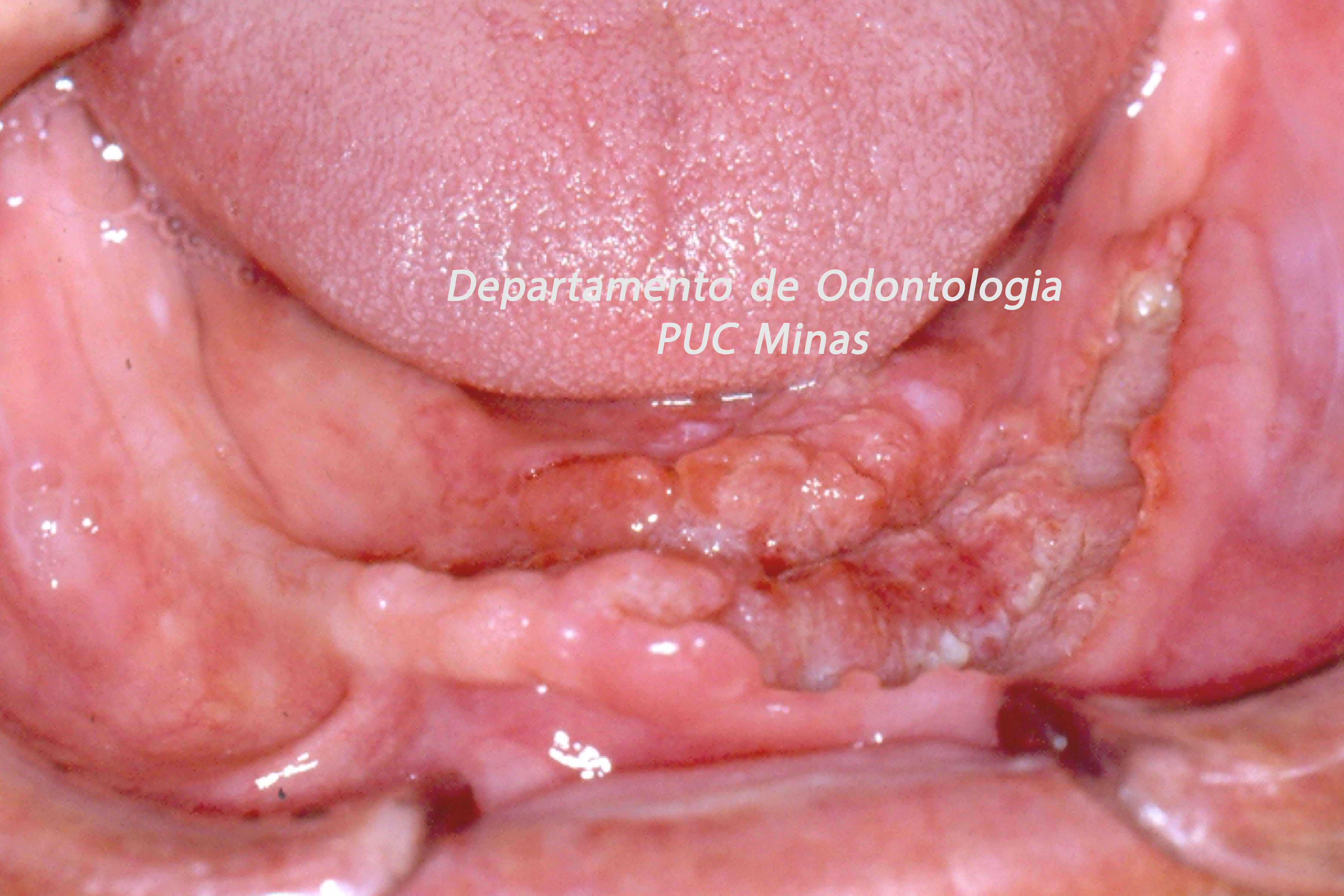
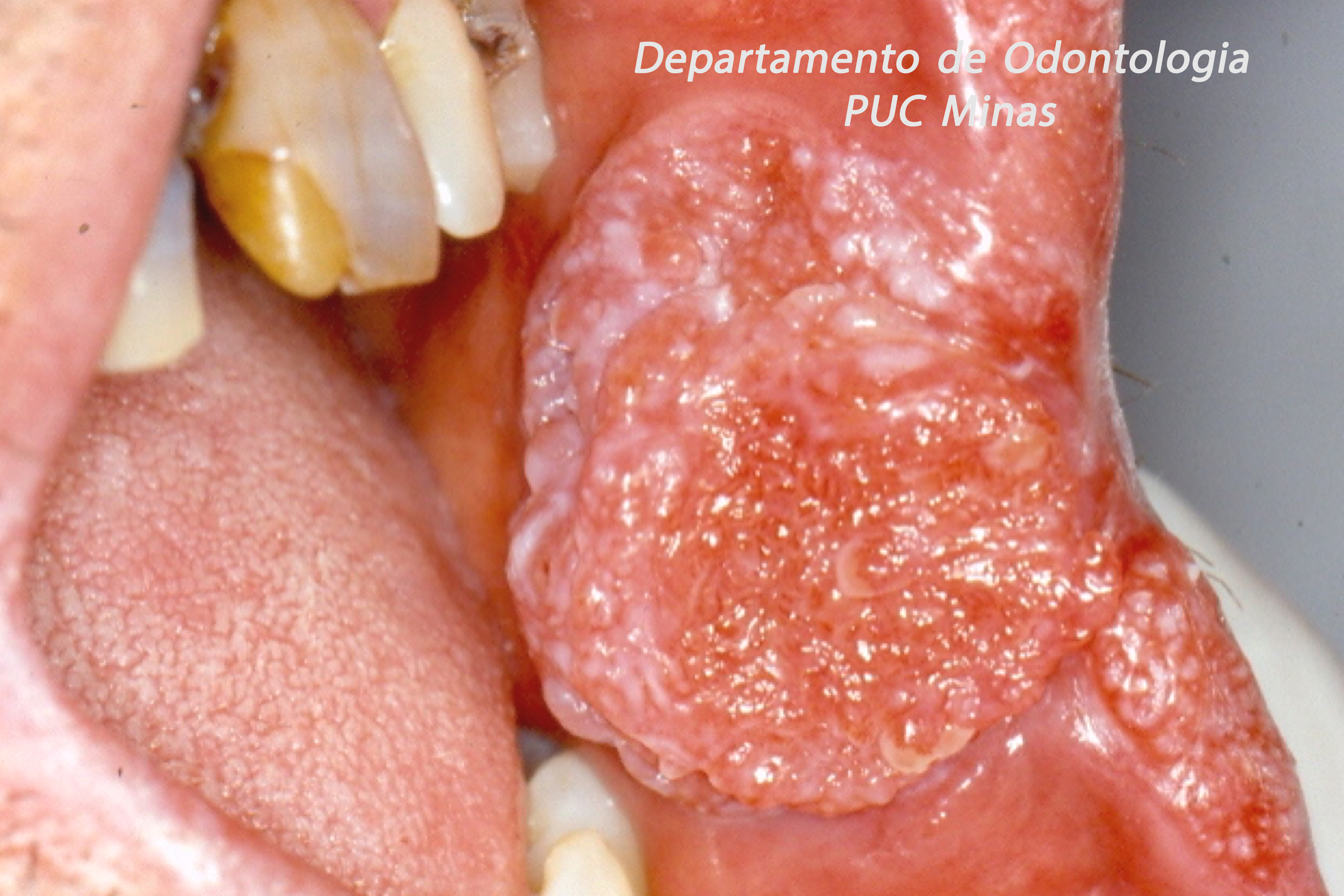
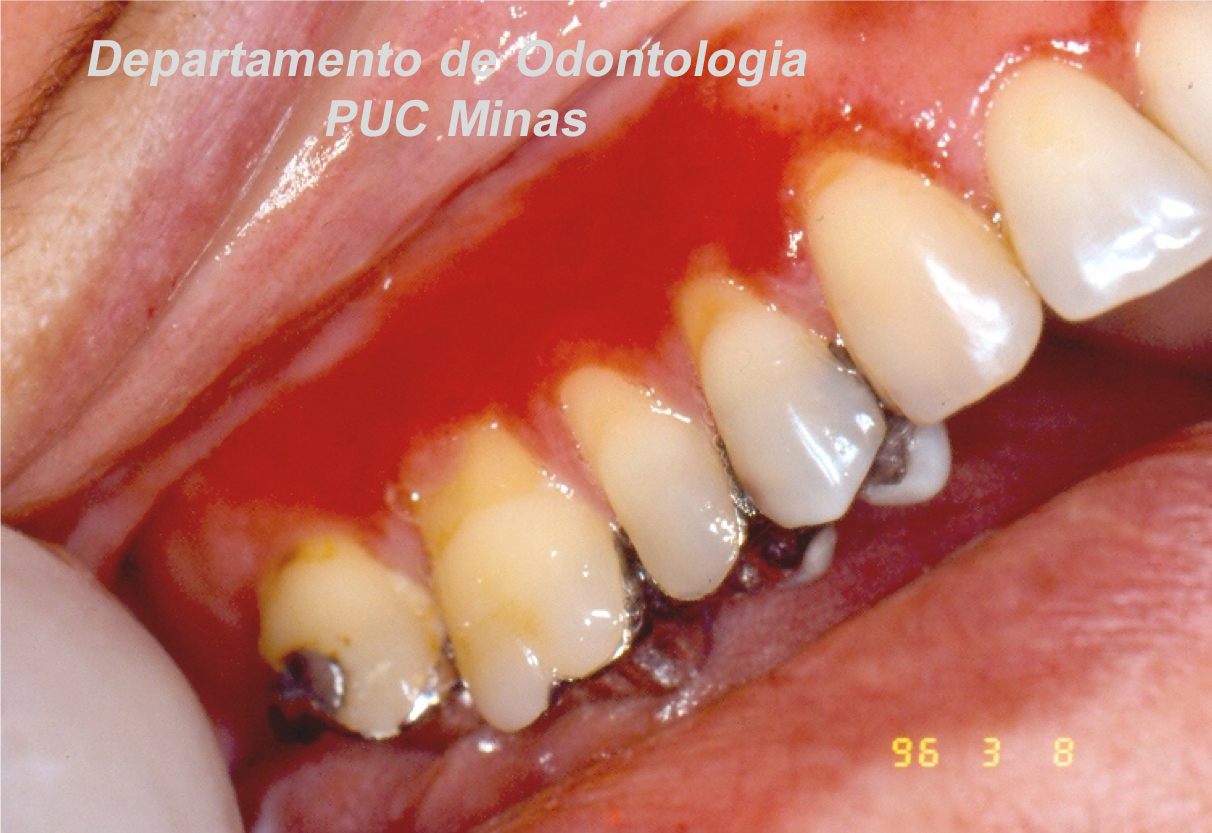
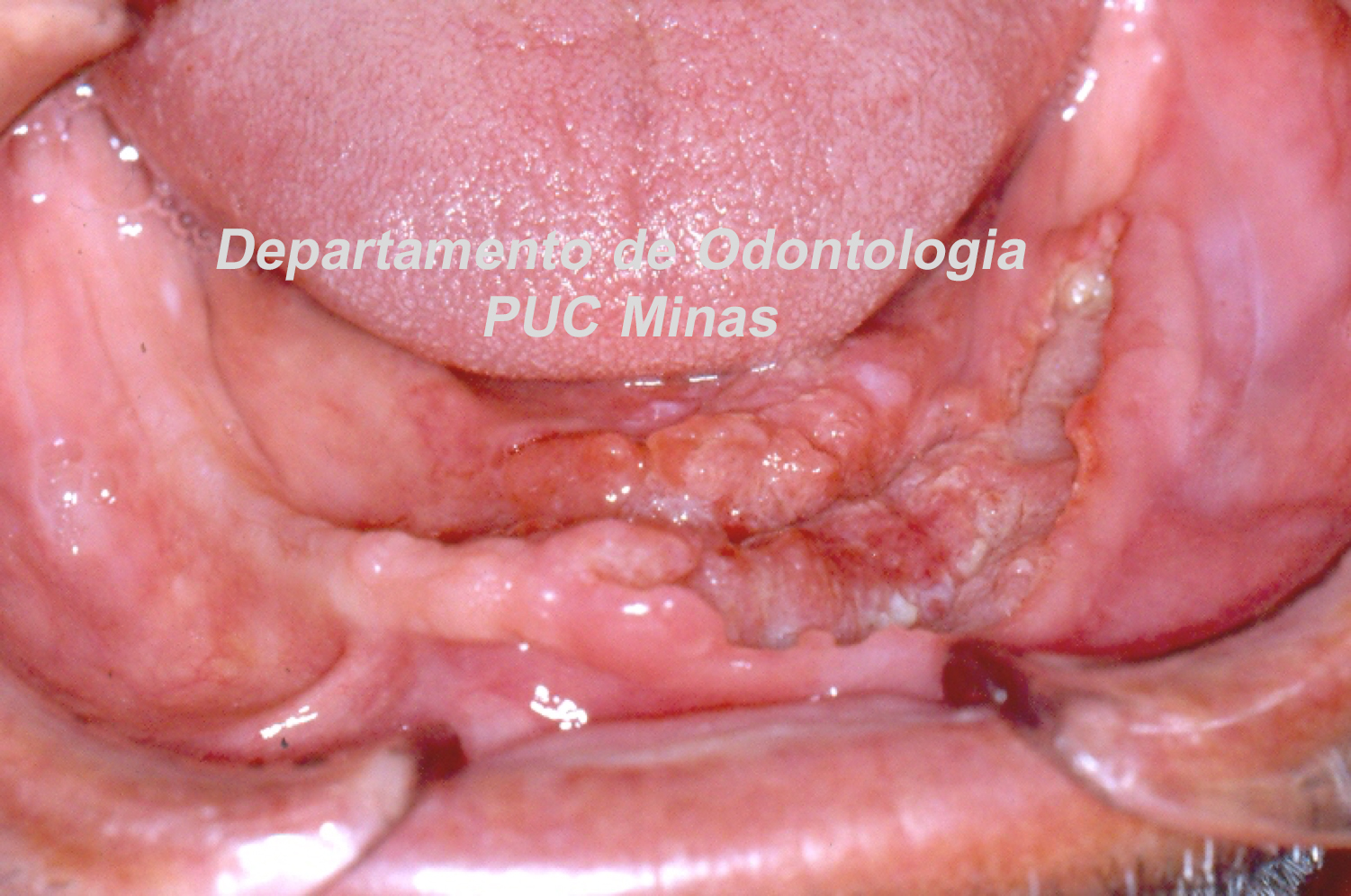
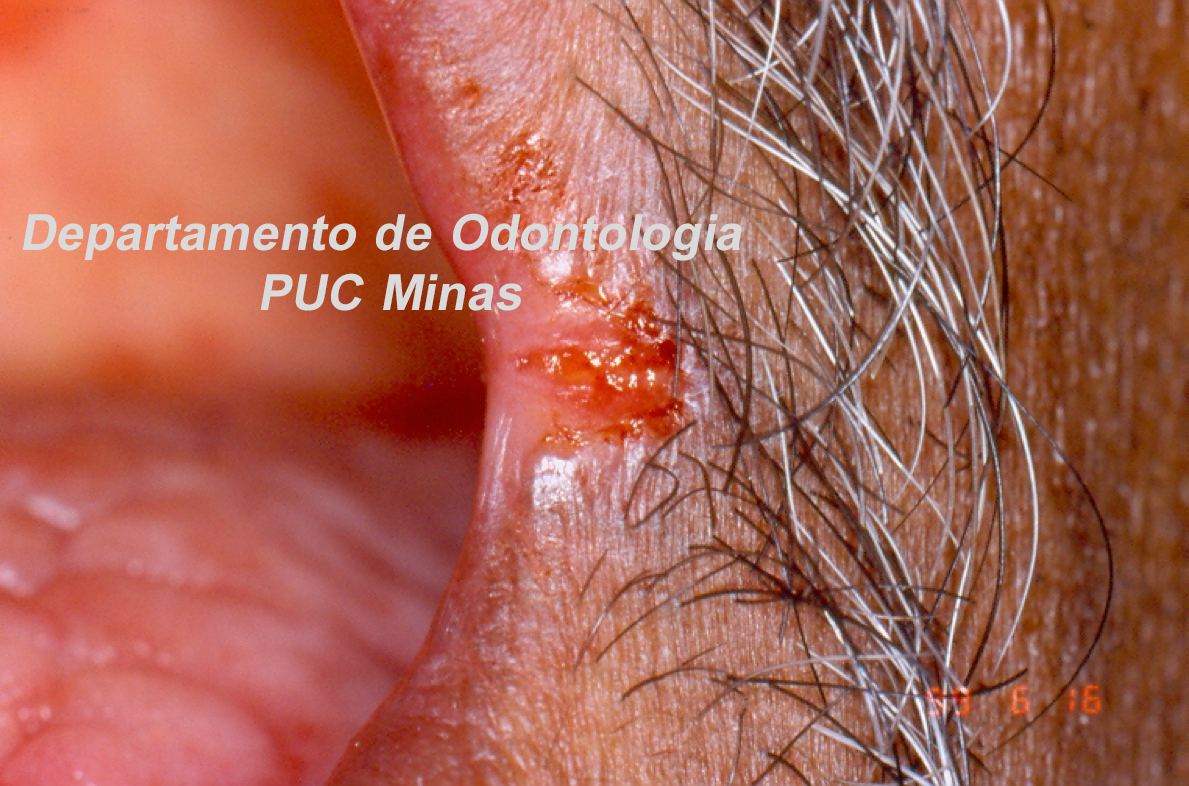
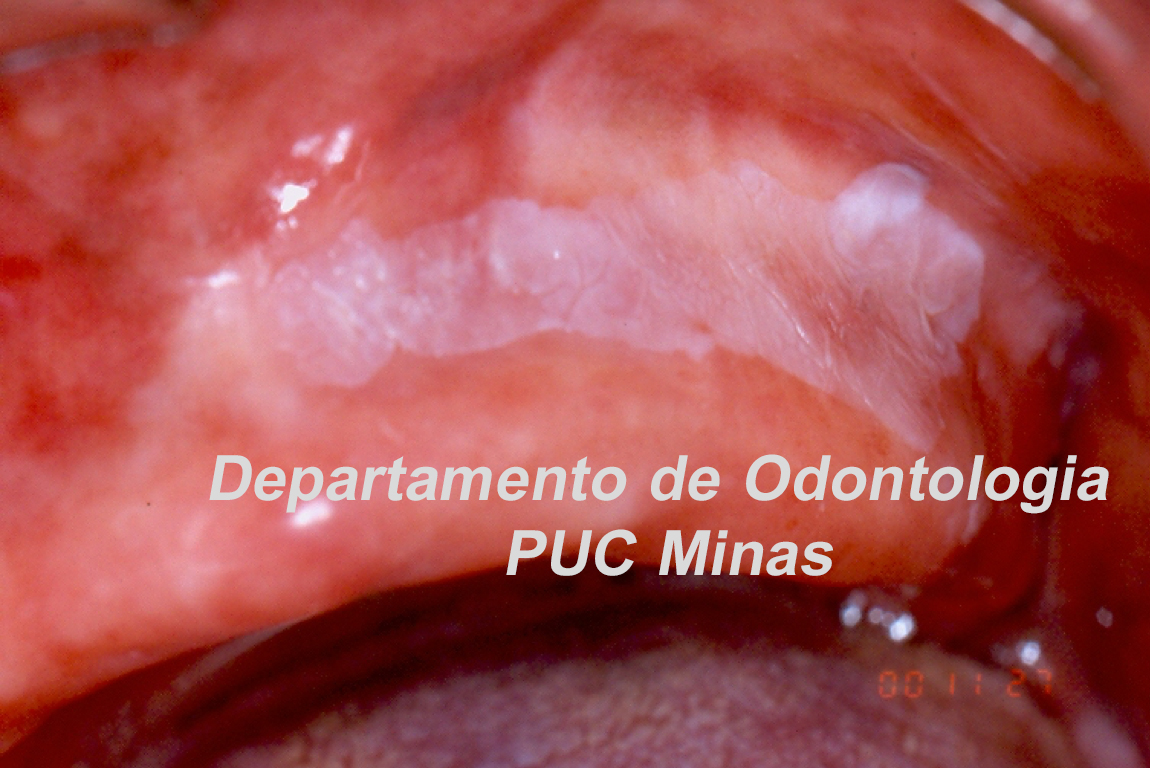
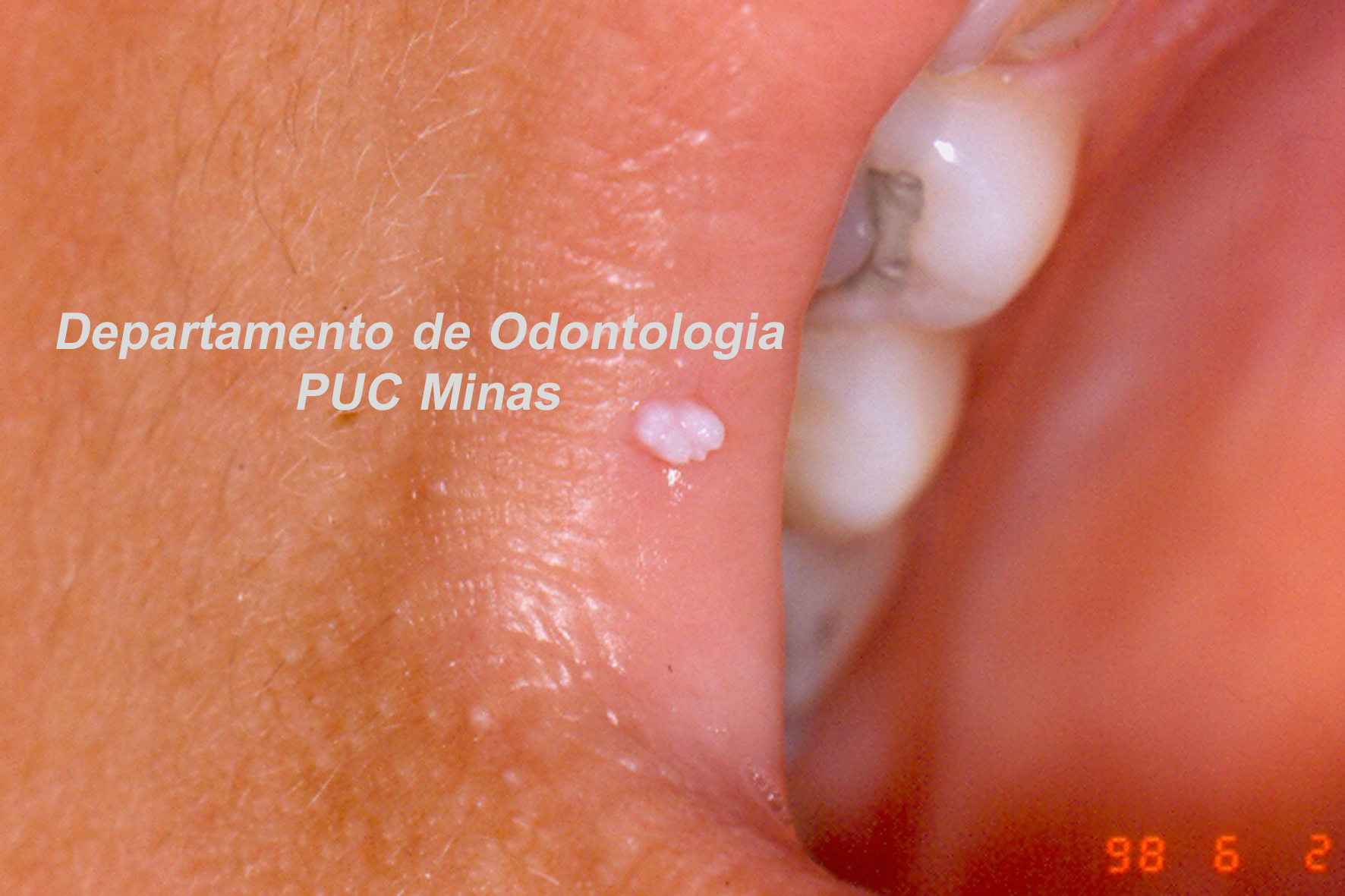
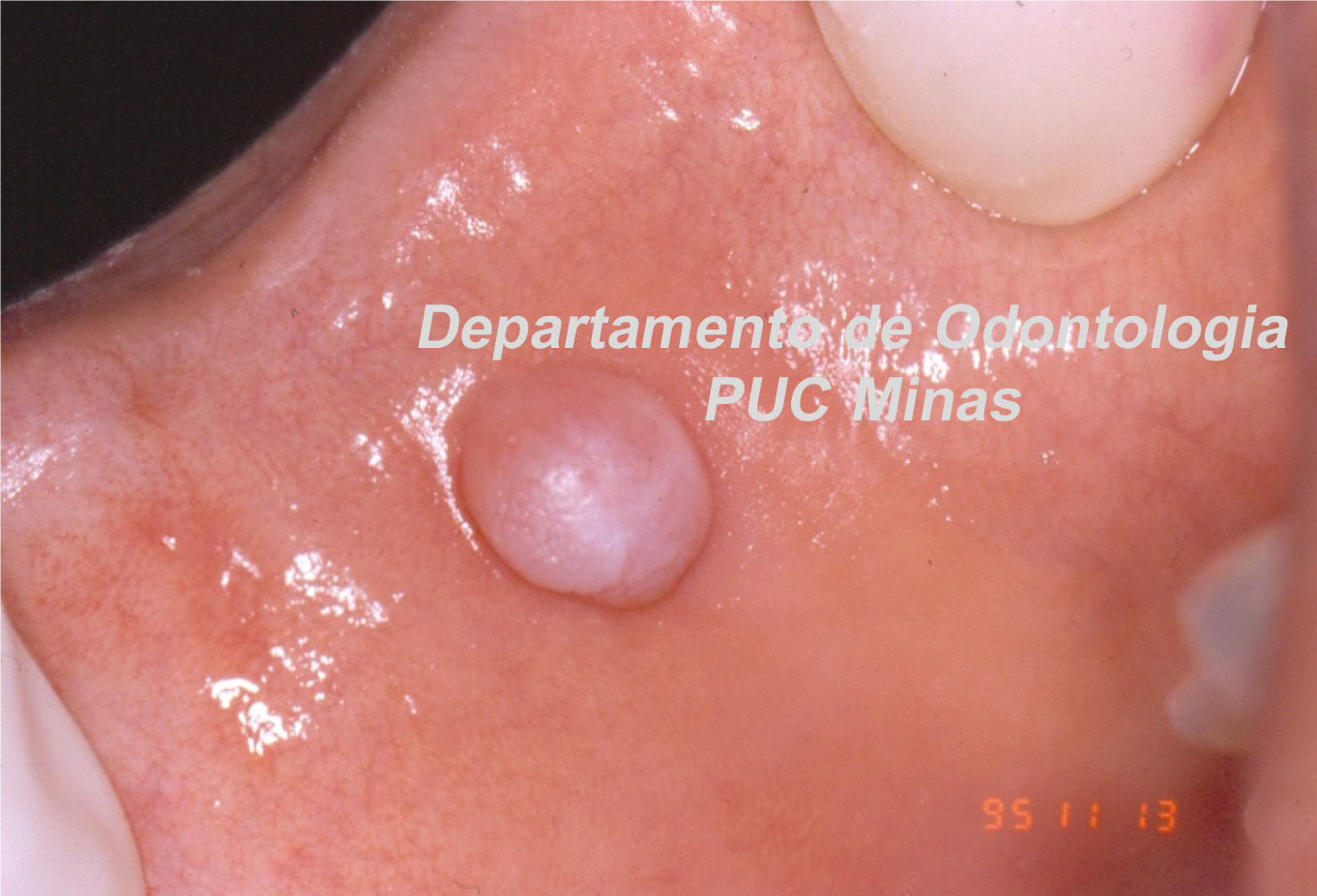
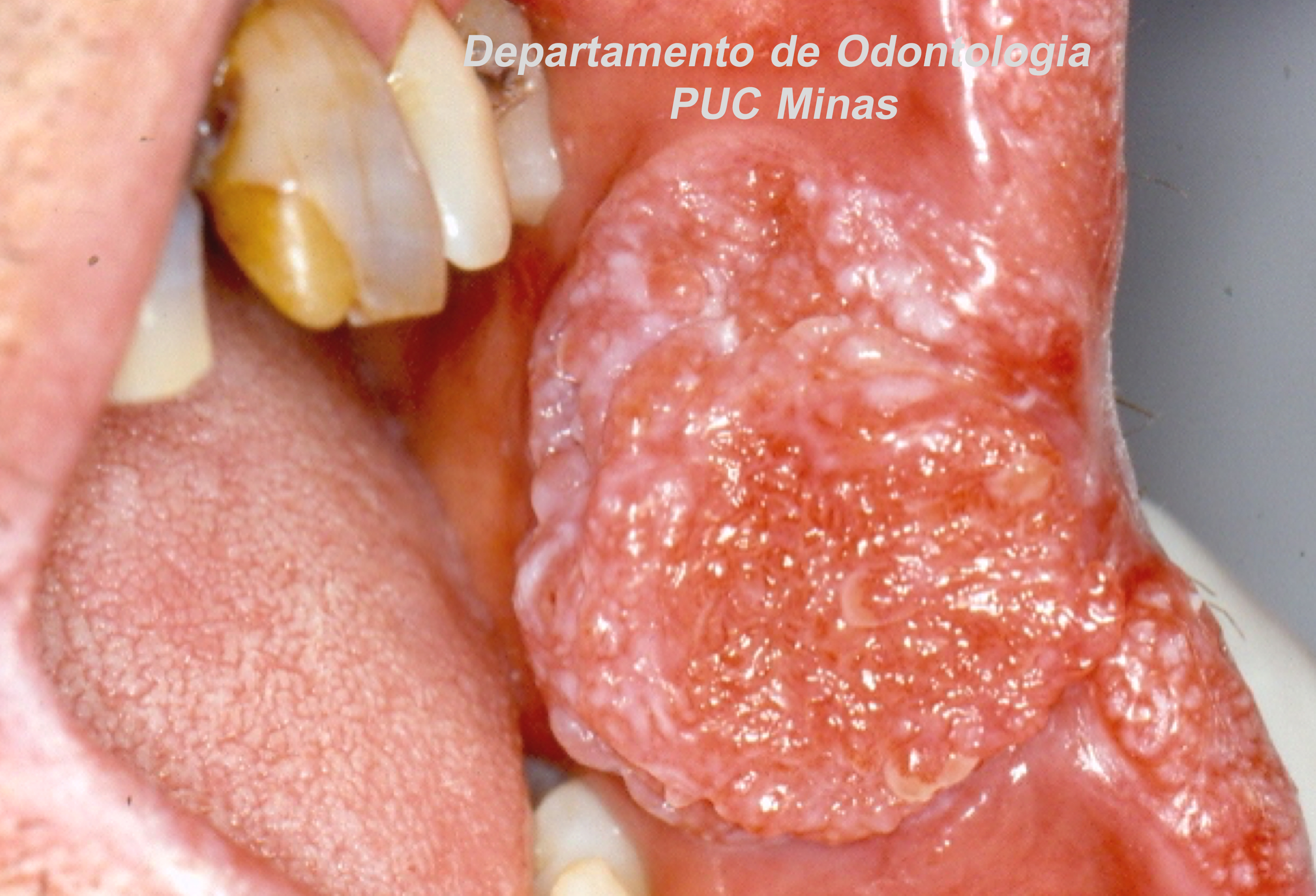
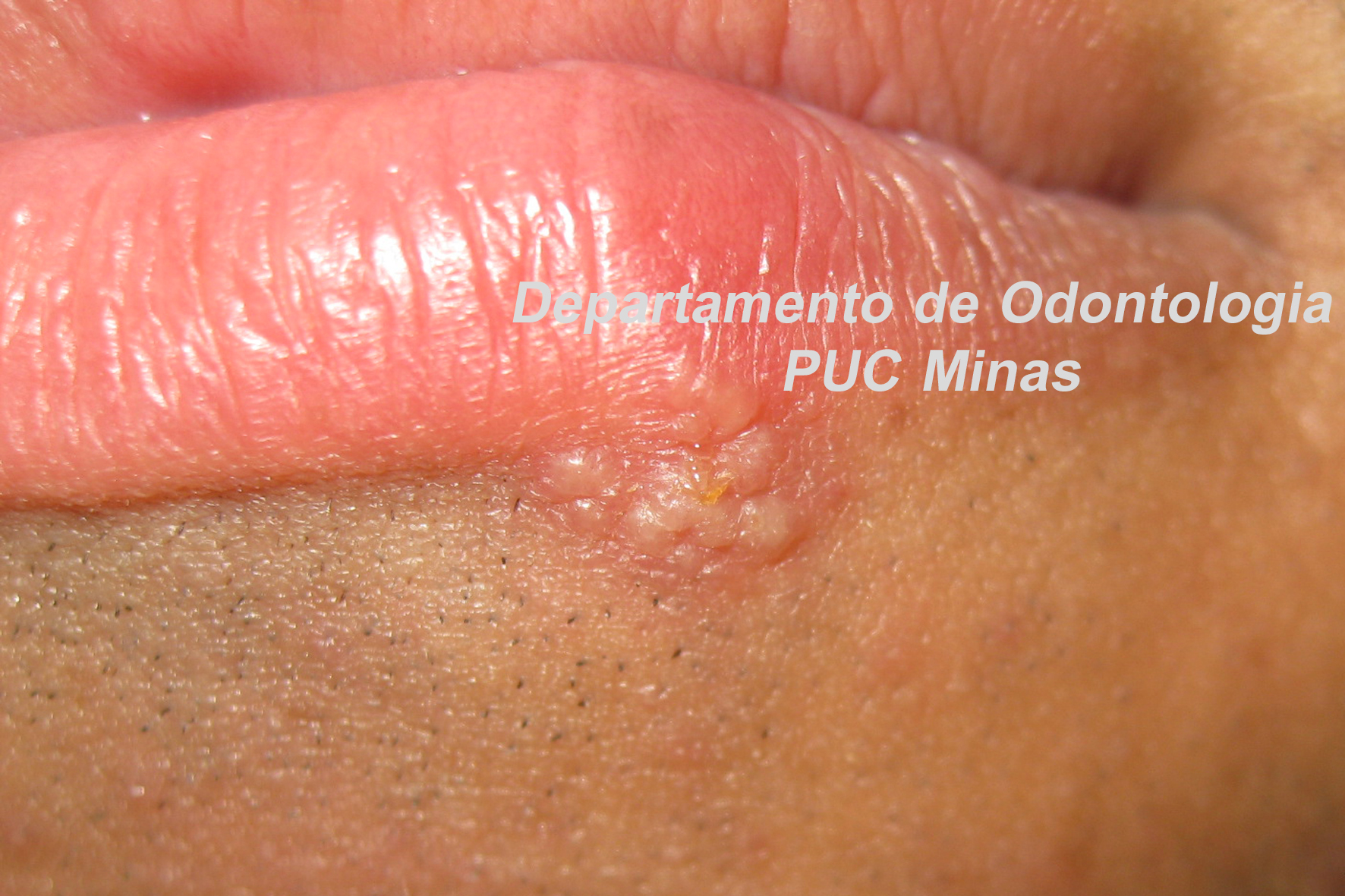
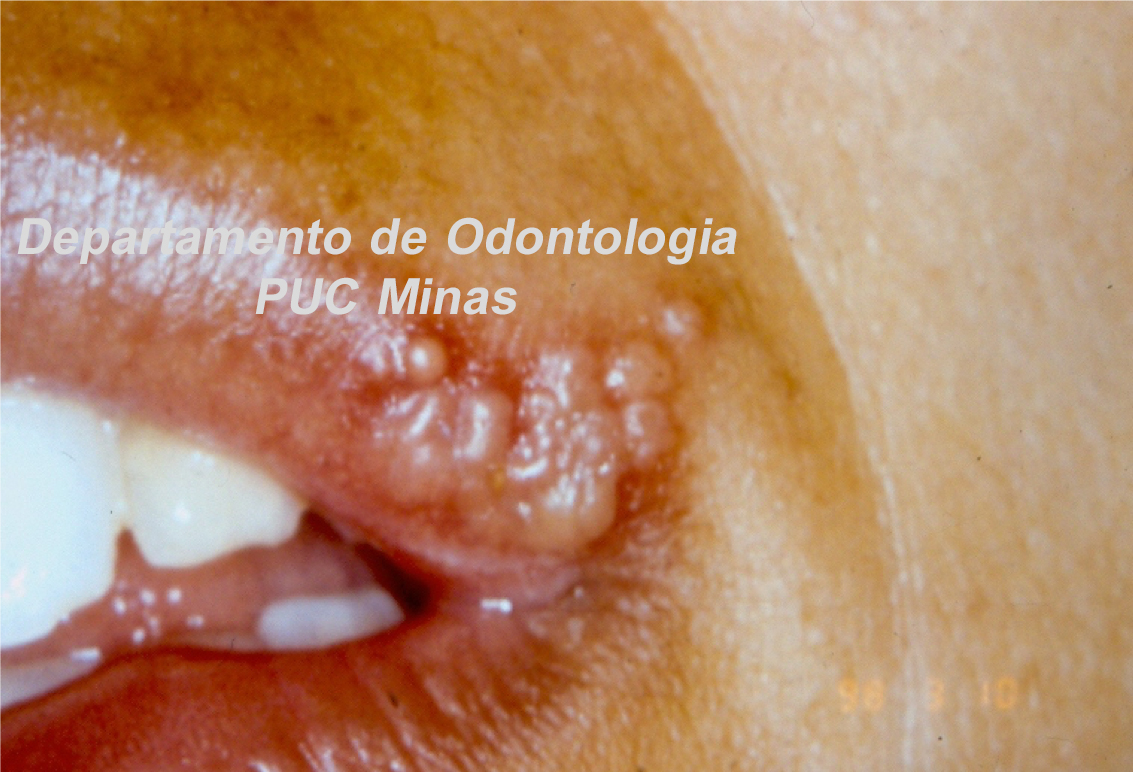
A peri-implantite, uma condição patológica associada ao biofilme peri-implantar, é caracterizada por inflamação na mucosa peri-implantar e perda progressiva de osso de suporte. O acúmulo do biofilme bacteriano pode causar inflamação nos tecidos ao redor do implante, resultando em mucosite peri-implantar (inflamação nos tecidos moles) e, peri-implantite (inflamação e reabsorção do tecido ósseo peri-implantar), podendo culminar na perda do implante. O diagnóstico baseia-se em características clínicas e radiográficas (FIGURA 1).
Tanto a mucosite quanto a peri-implantite são altamente prevalentes de acordo com o Workshop Mundial da AAP-EFP 2017 publicado em 2018 com ênfase na classificação das doenças e condições periodontais (HERRERA et al. 2023). Recentemente, uma diretriz de Prática Clínica foi publicada em 2023 pela Federação Europeia de Periodontologia, enfatizando que a peri-implantite é uma condição irreversível. Portanto, mesmo após uma terapia anti-infeciosa bem-sucedida, um diagnóstico de peri-implantite estável deve ser atribuído ao implante específico. Além disso, os resultados do tratamento dependem de diversos fatores, incluindo características macro e microestruturais dos implantes e protéticas, fatores do paciente, fatores locais, gravidade da doença e morfologia do defeito ósseo. De acordo com a diretriz da AAP-EFP (2023), no manejo cirúrgico de defeitos ósseos peri-implantares, o retalho de acesso com ou sem procedimentos reconstrutivos pode ser considerado, pois nenhuma evidência robusta demonstrou a superioridade de uma técnica cirúrgica específica (HERRERA et al. 2023).
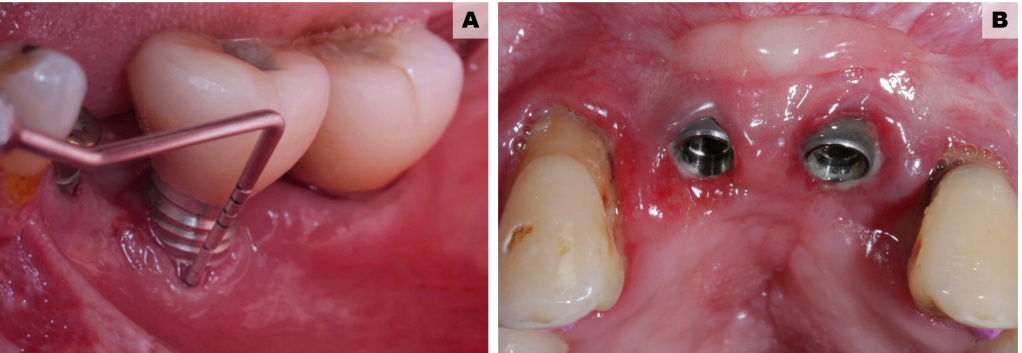
Dessa forma o diagnóstico e o tratamento da peri-implantite é complexo e controverso na literatura. Enquanto alguns autores como Karlsson et al., (2022) relataram que o tratamento cirúrgico sem a utilização de enxertos é eficaz, outros como Sinjab et al., (2018) enfatizam a necessidade de se realizar técnicas de regeneração óssea guiada (ROG) nessas situações.
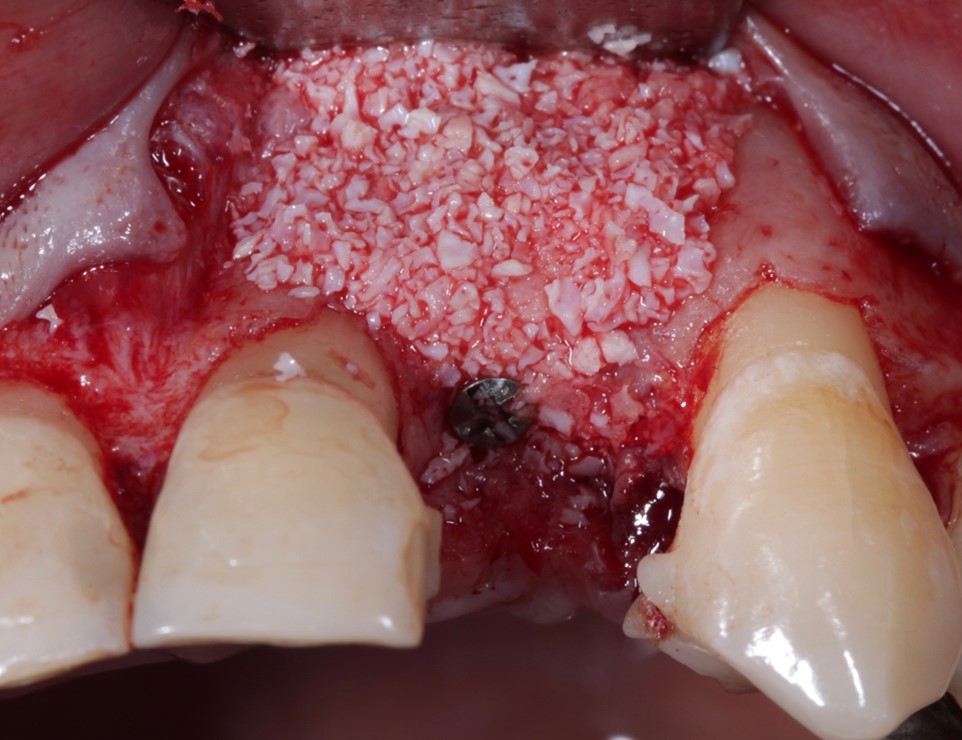
Descrita primeiramente por Dahlin et al. (1990) a ROG mostrou ser um sucesso em uma variedade de experimentos com diferentes biomateriais e membranas. Autores como Aghazadeh, Persson e Renvert (2020) mostraram em seu estudo que a configuração do defeito ósseo tem relação importante com os resultados obtidos, defeitos de 3 ou 4 paredes, com profundidade de no mínimo 3mm, apresentaram maiores taxas de neoformação óssea, quando técnicas de ROG foram realizadas. Sendo este o tratamento mais eficiente para os defeitos infra-ósseos. Nos defeitos supra ósseos (horizontais), a literatura aponta mais efetividade do tratamento por meio da implantoplastia, apontada como uma estratégia promissora para manutenção e prevenção da perda óssea peri-implantar.
No que diz respeito ao protocolo de ROG, Tomasi et al. (2019) enfatizaram que o osso xenógeno de origem bovina é o biomaterial de enxertia mais utilizado. No entanto, existem preocupações relacionadas aos enxertos xenógenos, como questões éticas e o risco de transmissão de príons, conforme Zenóbio et al. (2023) mencionam. Outros estudos, como o de Roos et al. (2014), descreveram bons resultados em cirurgia regenerativa com um substituto ósseo natural de fosfato de cálcio, associada a uma membrana.
Procedimentos regenerativos têm-se mostrado efetivos e com resultados previsíveis a longo prazo para a manutenção da saúde peri-implantar. Entretanto, os estudos mostraram que não há um preenchimento ósseo total do defeito e não há resolução completa da doença Peri-implantar com a ROG (AGHAZADEH, RUTGER PERSSON, RENVERT, 2012; ISLER et al., 2018; SCHWARZ et al., 2009; SCHWARZ et al., 2012; RENVERT et al., 2021).

Figura 1: Sequência de Diagnóstico da peri-implantite
Fonte: Adaptado do proposto por Herrera et al. (2023).
* É necessário a existência de dados de exames anteriores para verificar a ausência ou presença de aumento da profundidade de sondagem
** Em relação à porção mais coronal do implante ou na interface rugosa-lisa em implantes de nível de tecido.
Referências:
Aghazadeh A, Rutger Persson G, Renvert S. A single centre randomized controlled clinical trial on the adjunct treatment of intra‐bony defects with autogenous bone or a xenograft: results after 12 months. J Clin Periodontol. 2012; 39: 666-73.
Caton JG, Armitage G, Berglundh T, Chapple ILC, Jepsen S, Kornman KS, et al. A New Classification Scheme for Periodontal and Peri-Implant Diseases and Conditions – Introduction and Key Changes From the 1999 Classification. J Periodontol. 2018; 89:
DAHLIN, C. et al. Healing of maxillary and mandibular bone defects using a membrane technique: An experimental study in monkeys. Scandinavian Journal of Plastic and Reconstructive Surgery and Hand Surgery, v. 24, n. 1, p. 13-19, 1990.
Herrera D, Berglundh T, Schwarz F, Chapple I, Jepsen S, Sculean A, Kebschull M, Papapanou PN, Tonetti MS, Sanz M; EFP workshop participants and methodological consultant. Prevention and treatment of peri-implant diseases-The EFP S3 level clinical practice guideline. J Clin Periodontol. 2023 Jun;50 Suppl 26:4-76.
Isler SC, Soysal F, Ceyhanlı T, Bakırarar B, Unsal B. Regenerative surgical treatment of peri‐implantitis using either a collagen membrane or concentrated growth factor: a 12‐ month randomized clinical trial. Clin Implant Dent Relat Res. 2018; 20: 703-712
Karlsson K, Trullenque-Eriksson A, Tomasi C, Derks J. Efficacy of access flap and pocket elimination procedures in the management of peri-implantitis: A systematic review and meta-analysis. J Clin Periodontol. 2023 Jun;50 Suppl 26:244-284. doi: 10.1111/jcpe.13732. Epub 2022 Nov 3. PMID: 36217689.
Monje A, Pons R, Sculean A, Nart J, Wang HL. Defect angle as prognostic indicator in the reconstructive therapy of peri-implantitis. Clin Implant Dent Relat Res. 2023 Jul 5. doi: 10.1111/cid.13244. Epub ahead of print. PMID: 37405662.
Renvert S, Giovannoli JL, Roos-Jansåker AM, Rinke S.Surgical treatment of peri‐ implantitis with or without a deproteinized bovine bone mineral and a native bilayer collagen membrane: A randomized clinical trial. J Clin Periodontol. 2021; 48: 1312-1321.
ROOS, A. M. et al. Surgical treatment of peri‐implantitis using a bone substitute with or without a resorbable membrane: A 5‐year follow‐up. Journal of Clinical Periodontology, v. 41, n. 11, p. 1108-1114, 2014.
Schwarz F, Bieling K, Latz T, Nuesry E, Becker J. Healing of intrabony peri‐implantitis defects following application of a nanocrystalline hydroxyapatite (OstimTM) or a bovine‐ derived xenograft (Bio‐OssTM) in combination with a collagen membrane (Bio‐GideTM). A case series. J Clin Periodontol. 2006; 33: 491-9.
Schwarz F, Sahm N, Bieling K, Becker J. Surgical regenerative treatment of peri‐ implantitis lesions using a nanocrystalline hydroxyapatite or a natural bone mineral in combination with a collagen membrane: a four‐year clinical follow‐up report. J Clin Periodontol. 2009; 36: 807-14.
Sinjab K, Garaicoa-Pazmino C, Wang HL. Decision making for management of periimplant diseases. Implant Dent. 2018; 27: 276-281.
Tomasi C, Regidor E, Ortiz-Vigón A, Derks J. Efficacy of reconstructive surgical therapy at peri‐implantitis‐related bone defects. A systematic review and meta‐analysis. J Clin Periodontol. 2019; 46: 340-356.
Zenóbio EG, Resende DF, de Albuquerque VN, Mendes PA, de Abreu FAM, Côsso MG. How the use of xenogeneic grafts can impact the relationship with some social groups and blood donor patients. Clin Implant Dent Relat Res. 2023 May 10.