Programa de pós-graduação em Odontologia da PUC Minas (PPGO PUC Minas)
Gianfilippo Machado Cornacchia (1)
Polianne Alves Mendes(1)
Vitória Netto de Albuquerque (2)
Dayane Ferreira Resende (2)
Fernando Antônio Mauad de Abreu (2)
Elton Gonçalves Zenóbio(3)
Vânia Eloisa de Araújo Silva(3)
(1) Discente do curso de Doutorado Acadêmico em Clínicas odontológicas PPGO PUC Minas
(2) Discente do curso de Mestrado Acadêmico em Clínicas odontológicas PPGO PUC Minas
(3) Docente do PPGO PUC Minas
Os biomateriais são definidos como uma substância projetada para atuar direcionando as interações com componentes de sistemas vivos, durante o curso de qualquer procedimento terapêutico ou diagnóstico. No campo da saúde, a substituição e/ou o aumento de tecidos biológicos sempre foi um tema de importância, isso fez com que houvesse uma evolução de produtos naturais que perdura por mais de três milênios da história humana, resultando em substâncias complexas transformadas artificialmente e que hoje, para suprir essa demanda, são produzidos de formas diversas a partir de metais, cerâmicas, polímeros e compósitos (DALAPICULA et al., 2006; WILLIAMS, 2008; MARIN, BOSCHETTO e PEZZOTTI, 2020).
Os biomateriais substitutos ósseos podem ser classificados de acordo com sua origem, quanto suas propriedades ou resposta biológica (BAUER; MUSCHLER, 2000). Em relação a origem podem ser chamados de: autógenos quando obtidos do próprio indivíduo; Singênico substitutos obtidos entre indivíduos geneticamente idênticos (gêmeos), homógenos ou aloenxertos obtidos de doadores da mesma espécie; xenógenos ou enxerto heterógenos provenientes de doadores de espécies diferentes, fitogênicos que são biomateriais originários de plantas, em especial algas e enxertos aloplásticos obtidos de forma sintética (BAUER; MUSCHLER, 2000; OLIVER KLEIN e AL-NAWAS, 2011). Em relação as propriedades podem ser classificados como osteocondutores, osteoindutores ou osteogênicos. Já em relação a resposta biológica como bioinertes, biotolerantes ou bioativos (BURG; PARTER; KELLAN, 2000).
Assim essas substâncias integram os tecidos vivos de acordo com suas propriedades físico-químicas. Propriedades físicas que são específicas à área de superfície ou formato (bloco, partícula) e à porosidade (denso, macro ou micro poroso) e às propriedades químicas relacionadas a razão molar cálcio/fosfato, composição química, grau de impureza e substituição iônica na estrutura atômica (BURG; PARTER; KELLAN, 2000; MISCH, 2000).
As características estruturais dos biomateriais substitutos ósseos, utilizados em em odontologia, estão relacionadas desde a organização atômica em escala nanométrica, até́ ao nível da macroestrutura em escala milimétrica (TURRER; FERREIRA, 2008).
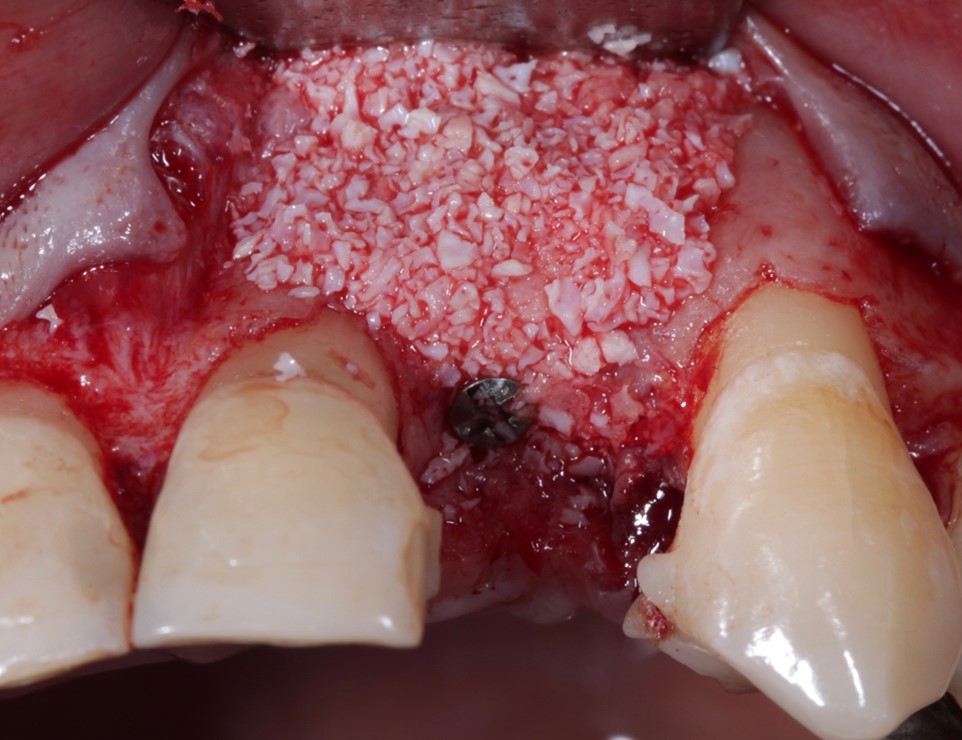
No procedimento cirúrgico de elevação da membrana do seio maxilar e enxertia com substitutos ósseos, os biomateriais mais utilizados são os de origem aloplástica e xenógena. Sendo os biomateriais aloplásticos mais utilizados as hidroxiapatitas sintéticas, fosfato tricálcico, bifásicos, biovidros e vitrocerâmicas, obtidos por meio de processamentos específicos em laboratório. Entre os xenógenos estão aqueles obtidos por meio da desproteinização do osso de origem bovina, porcina e equina, por meio de processos termoquímicos, que removem a porção orgânica do biomaterial (SCHOPPER et al., 2005; RODOLFO et al., 2017).
Parte da resposta biológica produzida por um biomaterial é condicionada por suas propriedades físico-químicas e estruturais (TRAJKOVSKI et al., 2018). São elas: porosidade, granulometria, morfologia, cristalinidade e razão cálcio/fosfato para o biomaterial (Figura 1).

Diante dos aspectos que envolvem o sucesso de uma cirurgia de levantamento do seio maxilar utilizando biomateriais xenogênicos ou aloplásticos, as características físico-químicas e estruturais são fatores determinantes no resultado da técnica. O atual conhecimento científico disponível sugere que as características mais importantes desses biomateriais são uma alta porosidade das partículas, um tamanho médio de 2,0 mm, formas poligonais, uma maior razão Ca/P no biomaterial e uma alta cristalinidade (FIGUEIREDO et al., 2013; TRAJKOVSKI et al., 2018).


REFERÊNCIAS
Bauer, T.W., & Muschler, G.F. (2000). Bone graft materials: an overview of the basic science. Clinical Orthopaedics and Related Research, 371, 10-27.
Burg, K.J., Porter, S., & Kellam, J.F. (2000). Biomaterial developments for bone tissue engineering. Biomaterials, 21, 2347-2359.
Conz, M.B., Campos, C.N., Serrão, S.D., Soares, G.A., & Vidigal Júnior, G.M. (2010). Caracterização físico-química de doze biomateriais utilizados como enxertos ósseos na Implantodontia. ImplantNews, 7, 541-546.
Cornacchia, G. M. Eficácia das características físico-químicas e estruturais dos biomateriais na formação óssea após elevação de seio maxilar: revisão sistemática da literatura. 2021. 65 f. Dissertação (Mestrado) – Pontifícia Universidade Católica de Minas Gerais, Programa de Pós-Graduação em Odontologia. Disponível em: <http://www.biblioteca.pucminas.br/teses/Odontologia_GianfilippoMachadoCornacchia_19288_Textocompleto.pdf.> Acesso em: 3 nov. 2021.
Dalapicula, S.S., Vidigal Junior, G.M., Conz, M.B., & Cardoso, E.S. (2006). Características físico-químicas dos biomateriais utilizados em enxertias ósseas. Uma revisão crítica. ImplantNews, 3, 487-491.
Figueiredo, A S. Estudo in Vivo De Caracterização Da Reacção Inflamatória pós Implantação De Biomateriais à Base De Hidroxiapatite Para Aplicação Em Medicina Dentária. 2013. Tese de Doutorado. Universidade de Coimbra.
Guastaldi, A.C., & Aparecida, A.H. (2010). Fosfatos de cálcio de interesse biológico: importância como biomateriais, propriedades e métodos de obtenção de recobrimentos. Química Nova, 33, 1352-1358. doi: 10.21577/0100- 4042.20170716
Karageorgiou, V., & Kaplan, D. (2005). Porosity of 3D biomaterial scaffolds and osteogenesis. Biomaterials, 26, 5474-5491. doi: 10.1016/j.biomaterials.2005.02.002.
Marin E, Boschetto F, Pezzotti G. (2020). Biomaterials and biocompatibility: An historical overview. J Biomed Mater Res A. 1;108(8):1617-1633.
Misch, C.E. (2000). Biomateriais utilizados em implantes dentários. In: Implantes dentários contemporâneos (2a ed.). São Paulo: Editora Santos, p. 271-302.
Oliver Klein, M; AL-NAWAS, B. For which clinical indications in dental implantology is the use of bone substitute materials scientifically substantiated? Systematic review, consensus statements and recommendations of the 1st DGI Consensus Conference in September 2010, Aerzen, Germany. European Journal of Oral Implantology, v. 4, 2011.
Oonishi, H. L. L. H. J. W. F. S. E. T. S. K. H. I., Hench, L. L., Wilson, J., Sugihara, F., Tsuji, E., Kushitani, S., & Iwaki, H. (1999). Comparative bone growth behavior in granules of bioceramic materials of various sizes. Journal of Biomedical Materials Research: An Official Journal of The Society for Biomaterials, The Japanese Society for Biomaterials, and the Australian Society for Biomaterials, v. 44, n. 1, p. 31-43, 1999.
Rodolfo, L. M., Machado, L. G., Betoni-Júnior, W., Faeda, R. S., Queiroz, T. P., & de Souza Faloni, A. P. (2017). Substitutos ósseos alógenos e xenógenos comparados ao enxerto autógeno: reações biológicas. Revista Brasileira Multidisciplinar-ReBraM, 20(1), 94-105.
Schopper, C., Moser, D., Goriwoda, W., Ziya‐Ghazvini, F., Spassova, E., Lagogiannis, G., … & Ewers, R. (2005). The effect of three different calcium phosphate implant coatings on bone deposition and coating resorption: A long‐term histological study in sheep. Clinical oral implants research, 16(3), 357-368.
Turrer, C.L., & Ferreira, F.P.M. (2008). Biomateriais em cirurgia craniomaxilofacial: princípios básicos e aplicações: revisão de literatura.Revista Brasileira de Cirurgia Plástica, 23, 234-239.
Williams, D.F. (2008). On the mechanisms of biocompatibility. Biomaterials,29, 2941-2953. doi: 10.1016/j.biomaterials.2008.04.023.
Yang Y, Dennison D, Ong JL. (2005). Protein adsorption and osteoblast precursor cell attachment to hydroxyapatite of different crystallinities. Int J Oral Maxillofac Implants. 20(2):187-92.