Programa de Pós-graduação em Odontologia da PUC Minas (PPGO PUC Minas)
Anna Carolina Machado Vieira (2)
Mariana Silveira Souza (1)
Clarice Alves de Oliveira (2)
Laura Cascão Lopes (2)
Laura Maria de Almeida Araújo (1)
Mariela Dutra Gontijo de Moura (3)
Soraya de Mattos Camargo Grossmann (4)
1Alunas do Curso de Graduação em Odontologia da PUC Minas
2Cirurgiãs-dentistas
3Pós Doutoranda do Programa de Pós-Graduação em Odontologia da PUC Minas
4Docente do Programa de Pós-Graduação em Odontologia da PUC Minas
CONCEITO e ETIOLOGIA
A síndrome de Sjögren é uma doença autoimune sistêmica inflamatória crônica, caracterizada pela infiltração linfo-plasmocitária de vários órgãos, sendo as glândulas lacrimais e salivares as mais acometidas, levando a xeroftalmia (olhos secos) e a xerostomia (sensação de boca seca). É considerada como uma das doenças reumatológicas inflamatórias mais comuns (Bowman, 2018; Thorne et al., 2017).
Embora tenha uma etiologia desconhecida, a Síndrome de Sjögren é considerada uma doença autoimune associada à níveis aumentados de auto anticorpos no plasma dos pacientes (Bowman, 2018; Stefanski et al., 2017).
SUBTIPOS
Pode ser classificada como primária ou secundária. A forma primária caracteriza-se pela presença de xeroftalmia e xerostomia sem associação com outras doenças autoimunes. Já a sua forma secundária, além da xeroftalmia e xerostomia está associada a presença de outras doenças autoimunes tais como lúpus eritematoso, artrite reumatoide e outras doenças reumatológicas. Além da xerostomia, os pacientes podem apresentar diminuição da lubrificação da pele, rins, sistema respiratório, dentre outros (Bowman, 2018; Mavragani et al., 2006).
DIAGNÓSTICO
Para estabelecer o diagnóstico, os pacientes precisam apresentar sintomas de secura nos olhos e na boca (xeroftalmia e xerostomia, respectivamente), há pelo menos 3 meses (Thorne et al., 2017; Mavragani et al., 2006).
É imprescindível realizar exames laboratoriais, que podem amplamente sugerir o diagnóstico da Síndrome de Sjögren, tais como (Stefanski et al., 2017; Cartee et al., 2015):
-Hemograma Completo
– anti-SSA
– anti-SSB
– Fator Reumatóide (FR)
– Fator Anti-Nuclear (FAN)
Também é recomendado a realização do anti-HCV, para excluir a Síndrome de Sjögren, uma vez que os pacientes com Hepatite C apresentam sintomas semelhantes aos da Síndrome de Sjögren, mas são classificados de Síndrome de Sjögren like (Stefanski et al., 2017; Vitali et al. 2021).
A avaliação oftalmológica é realizada por meio da mensuração da secreção lacrimal por meio do teste de Schirmer e o teste de Rosa Bengala (Vitali et al., 2021; Mavragani et al., 2006).
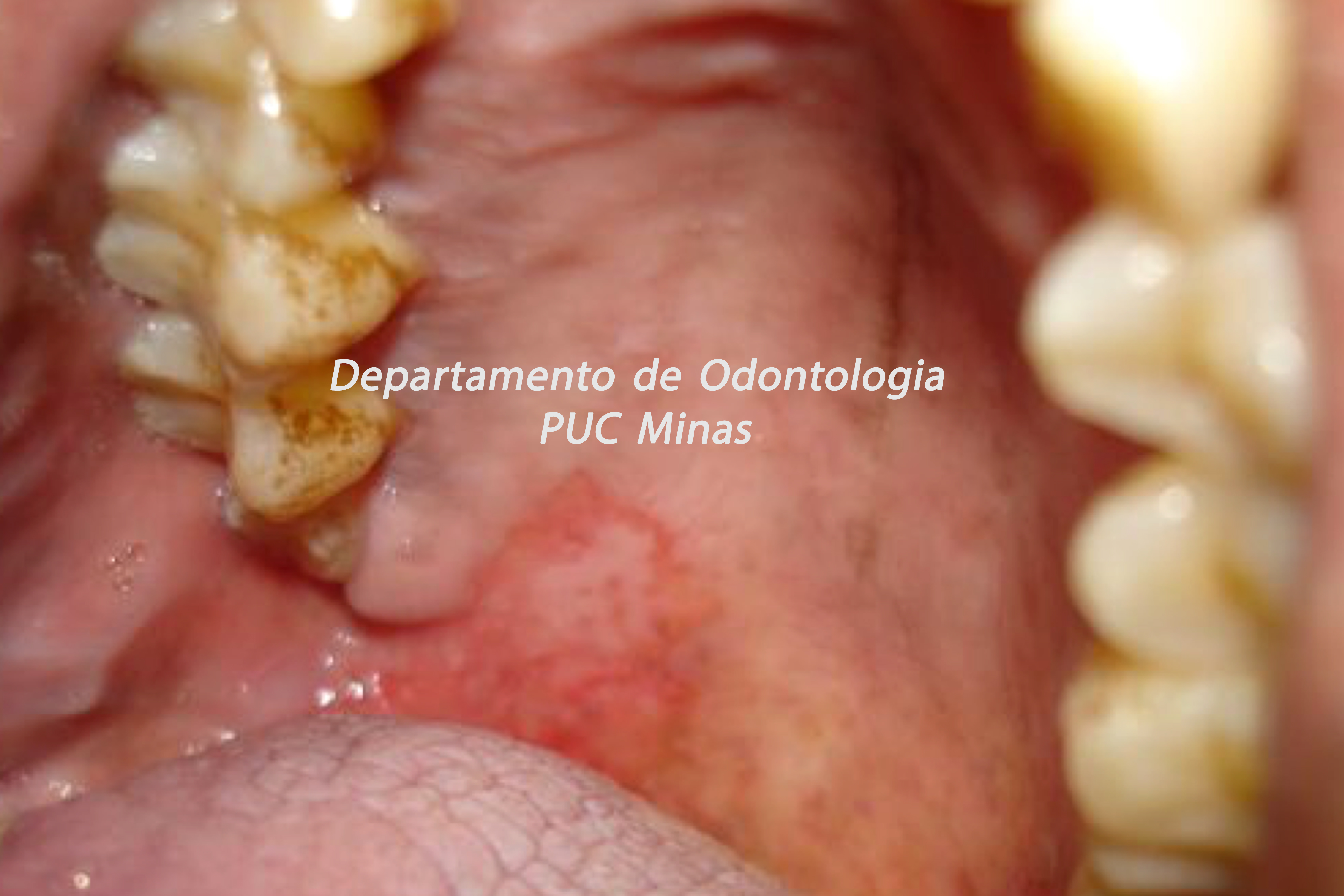
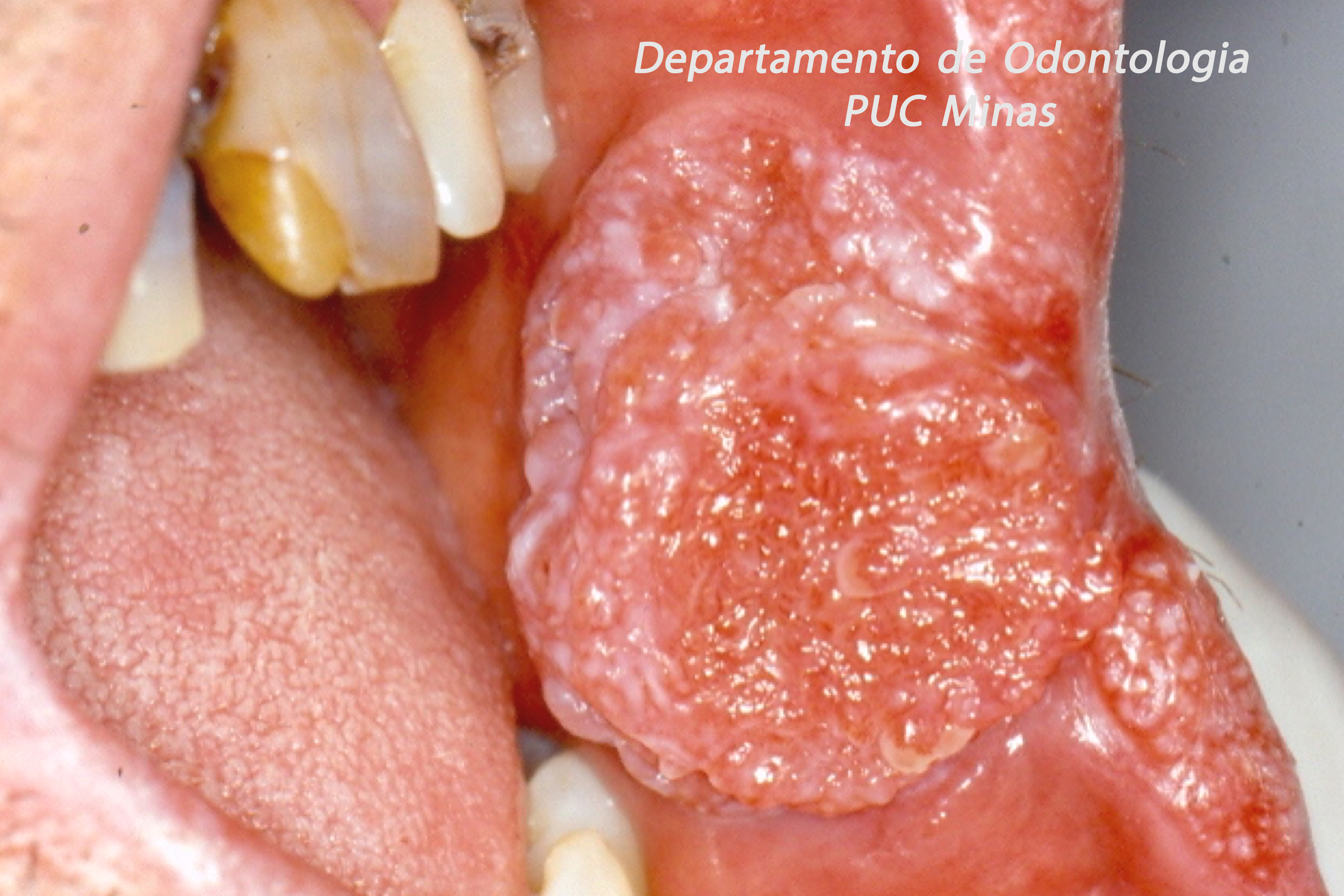
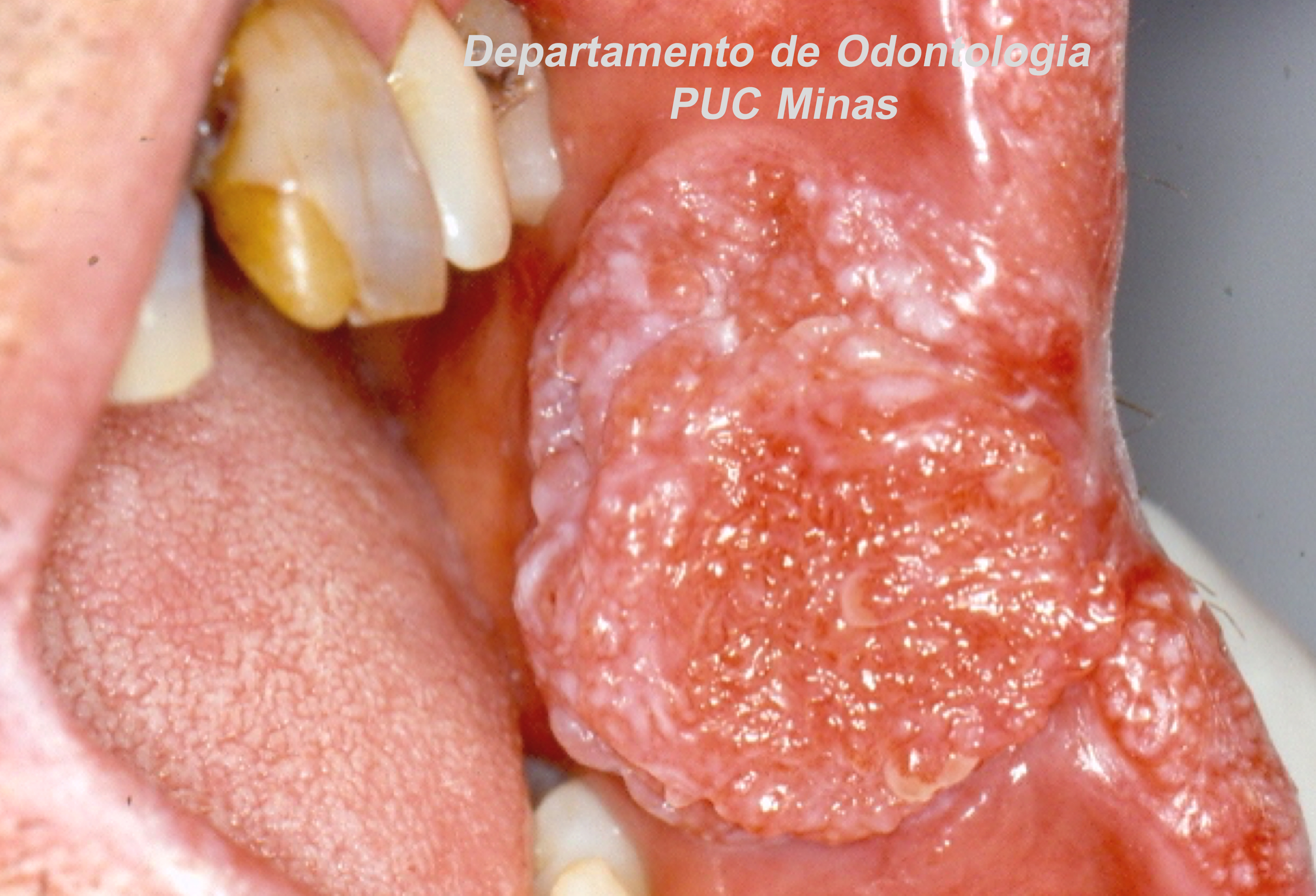
Para avaliação do fluxo salivar, a sialometria é o exame indicado para verificar a hipossalivação. O fluxo salivar deve ser mensurado em repouso e de forma estimulada. Assim, a sialometria além de medir o volume de saliva que é produzido por minuto, permite avaliar também a densidade, a viscosidade, a turbidez, a coloração e o pH salivar (Visser et al., 2020).

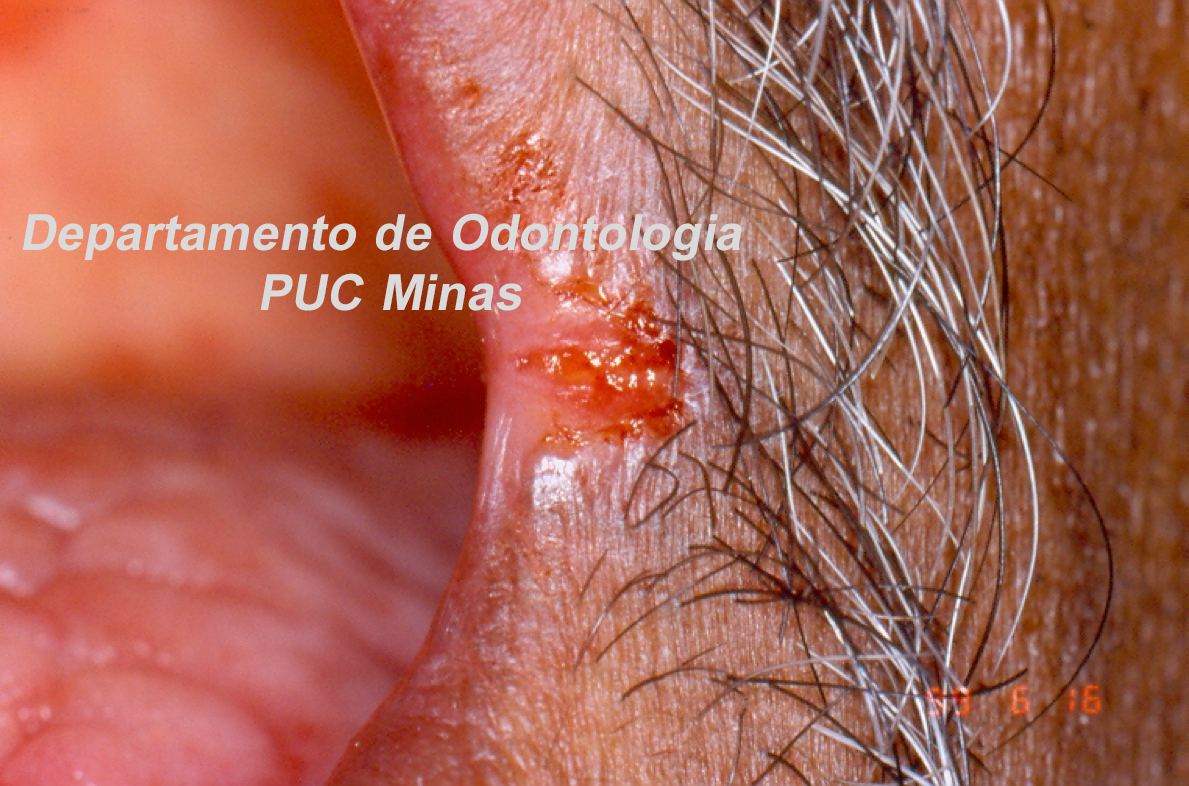
Figura 1: Sialometria, em repouso, demonstrando a coleta da saliva pelo método de escoamento passivo em paciente com Síndrome de Sjögren. Fonte da imagem: Arquivos do Departamento de Odontologia da PUC Minas
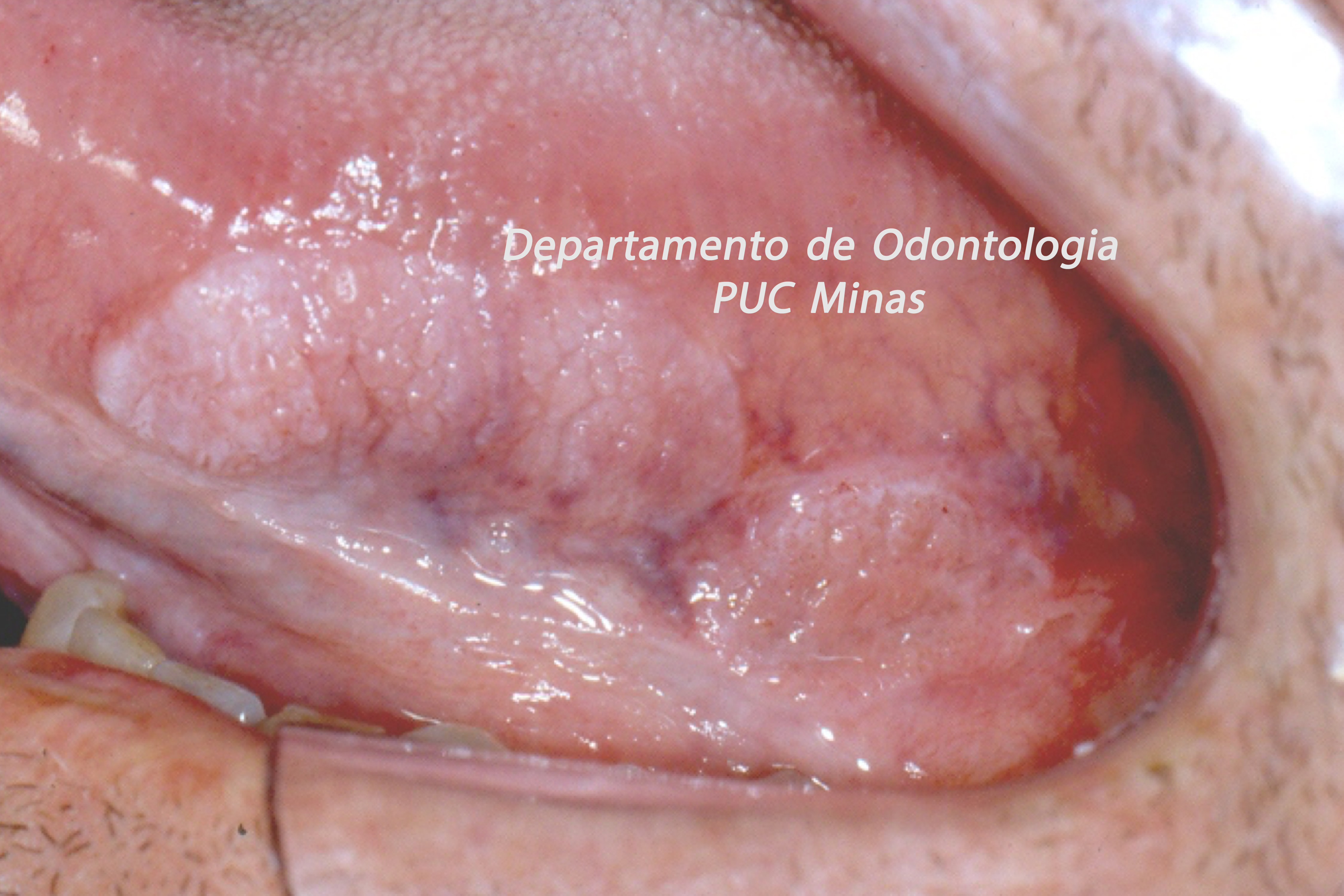
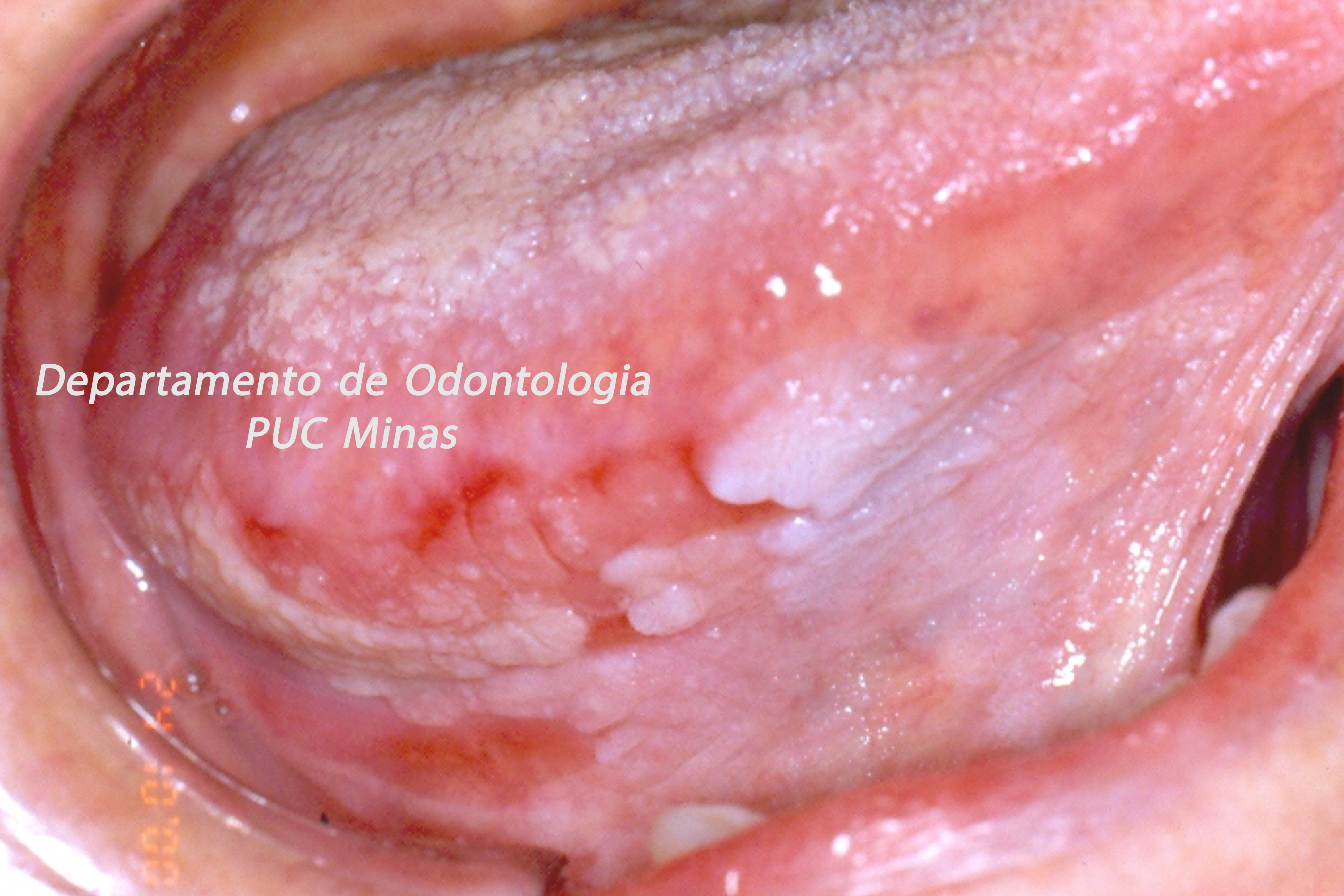
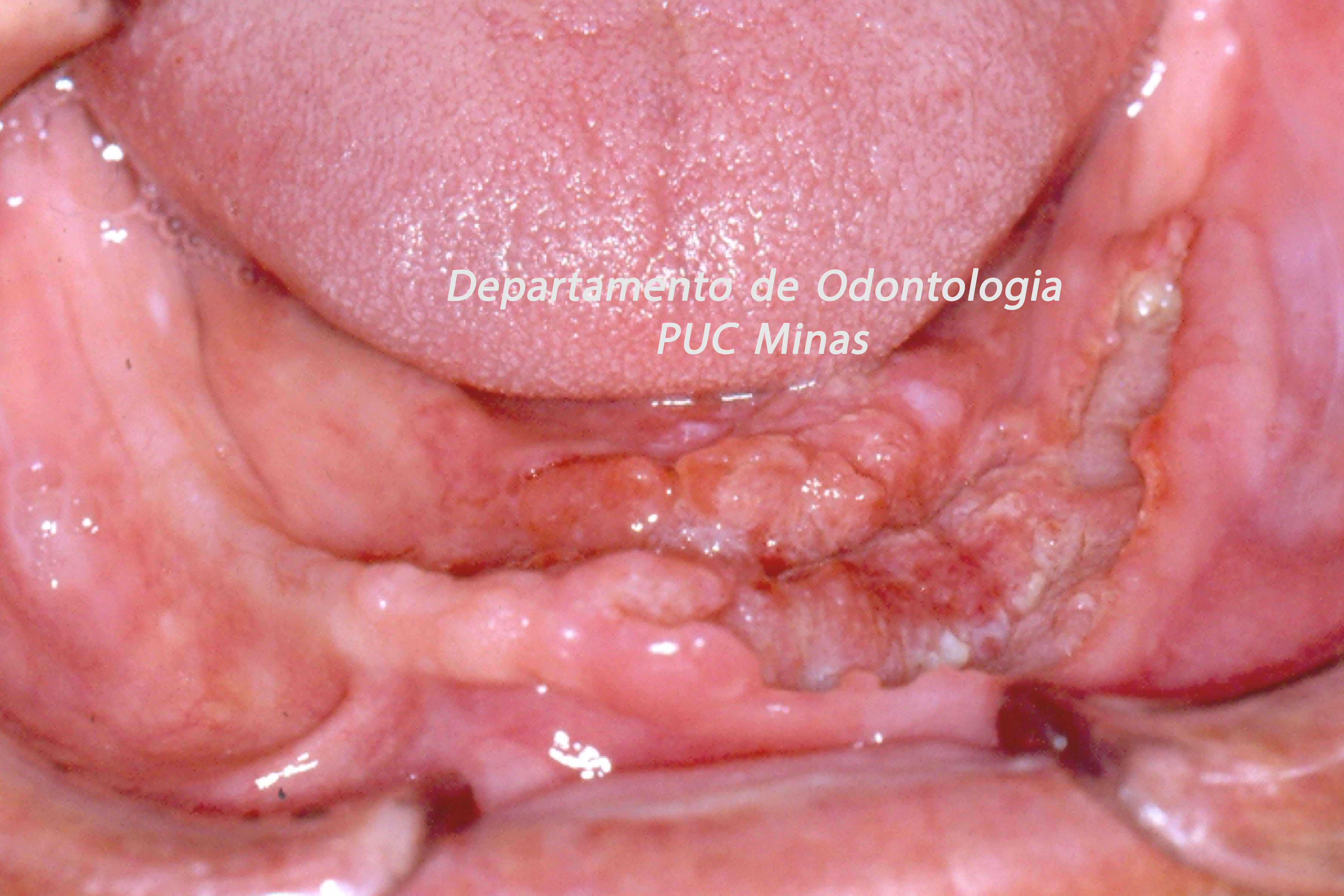
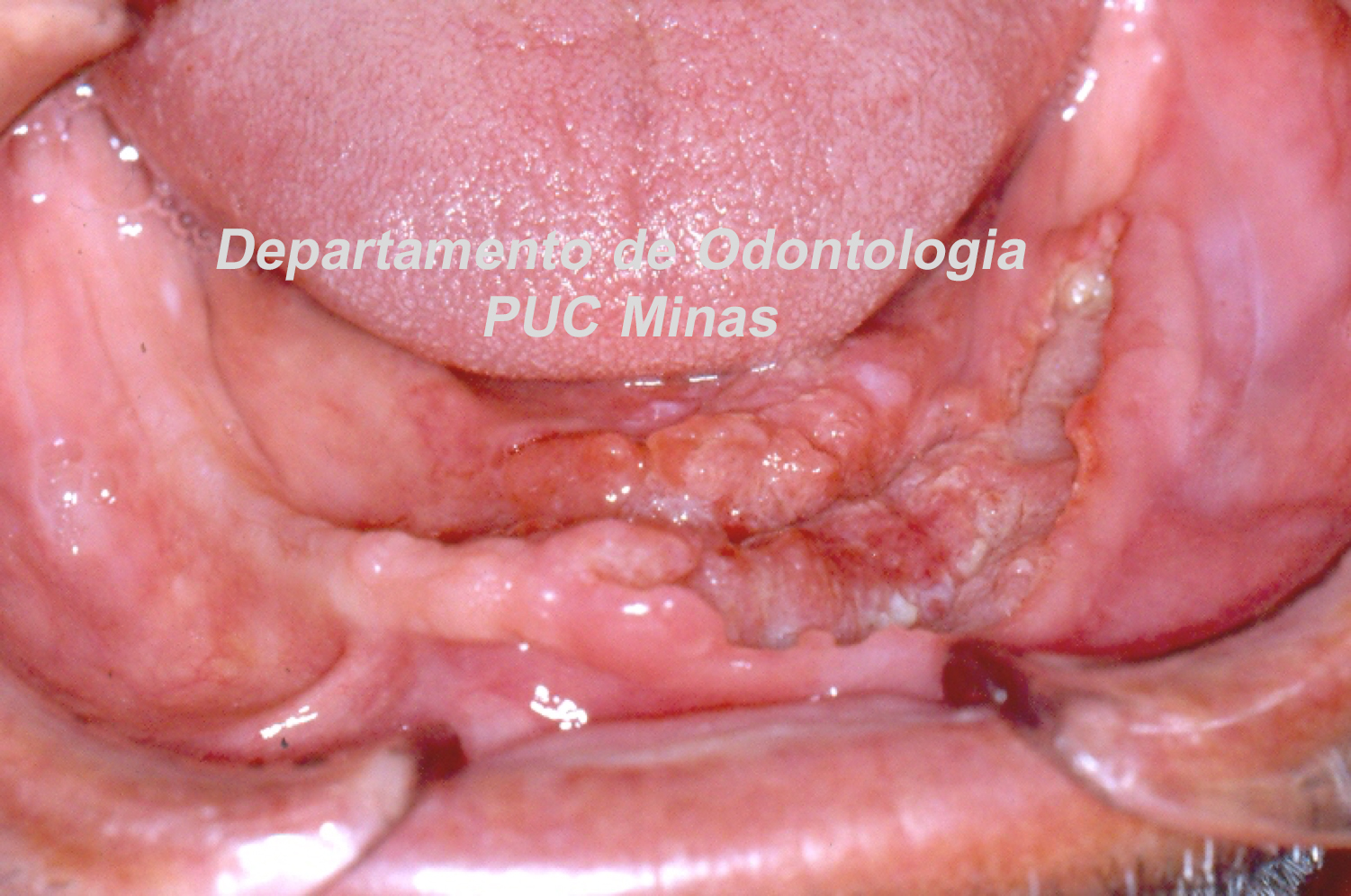
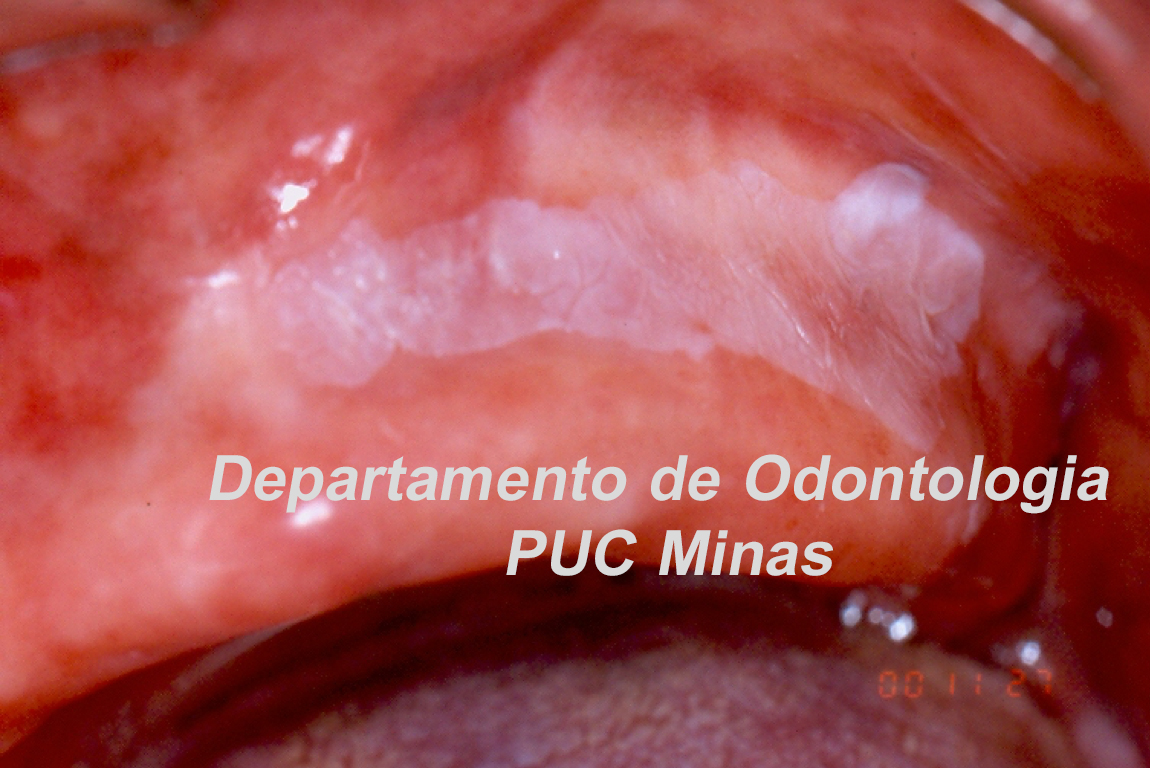
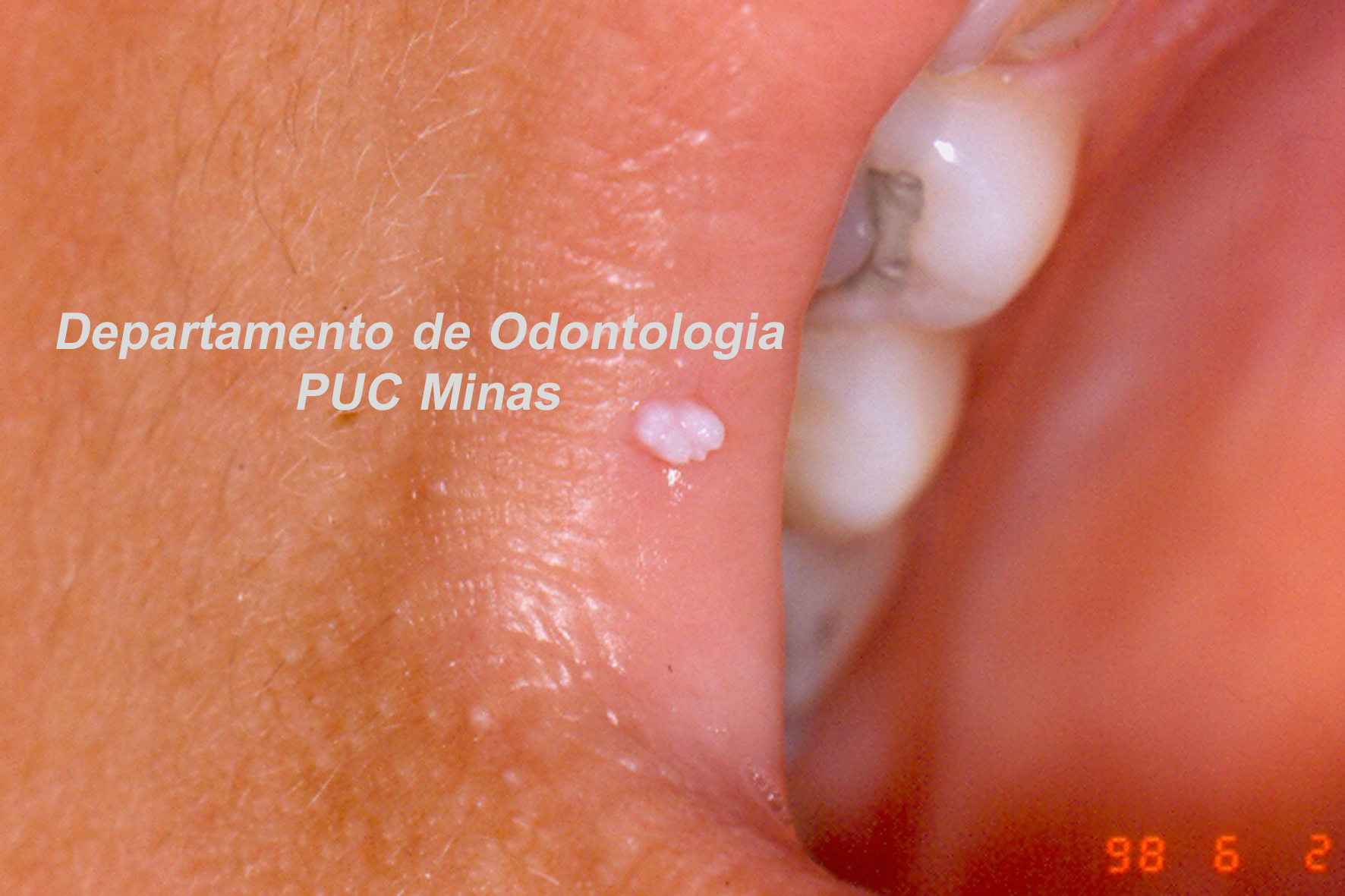
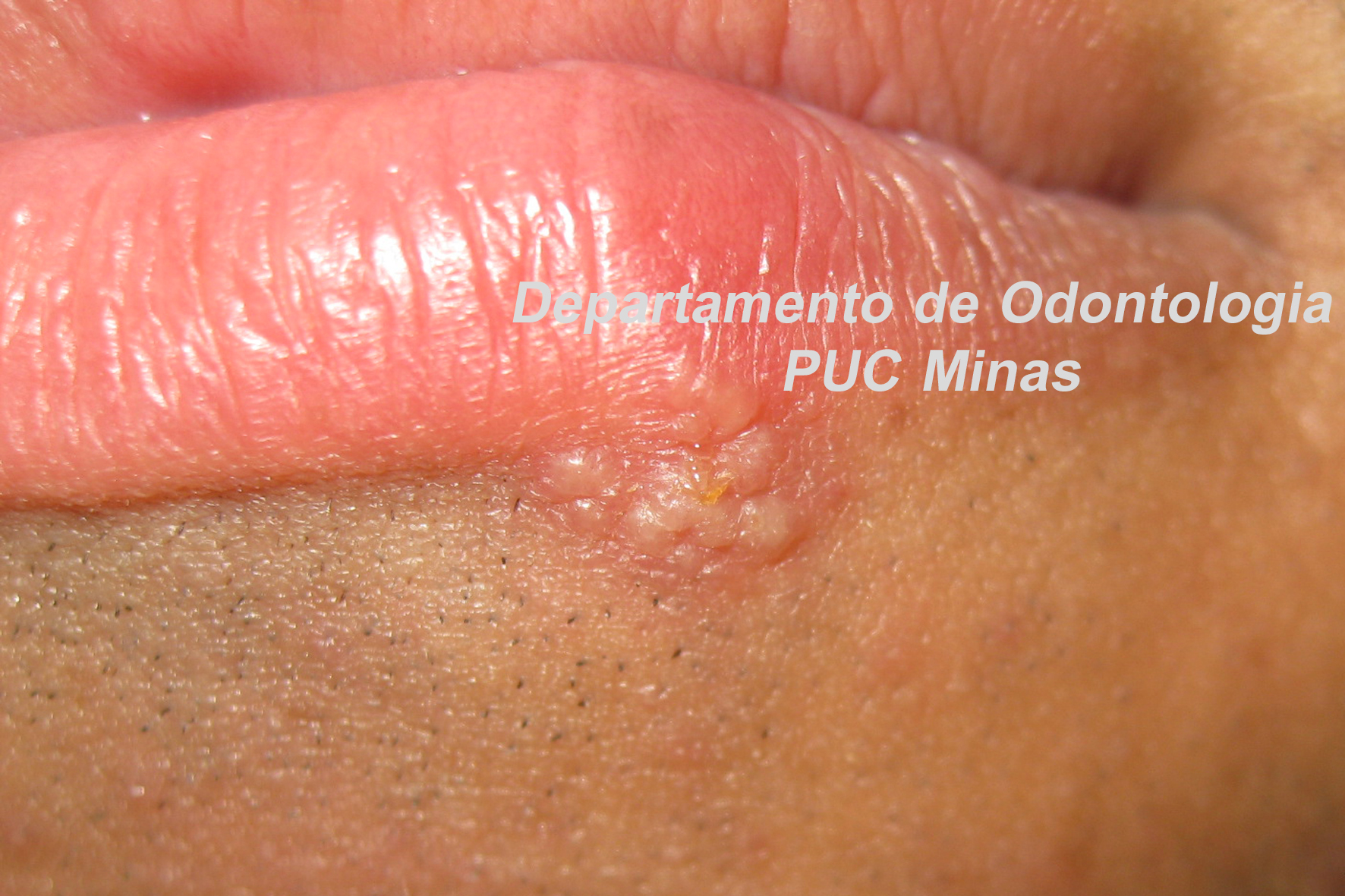
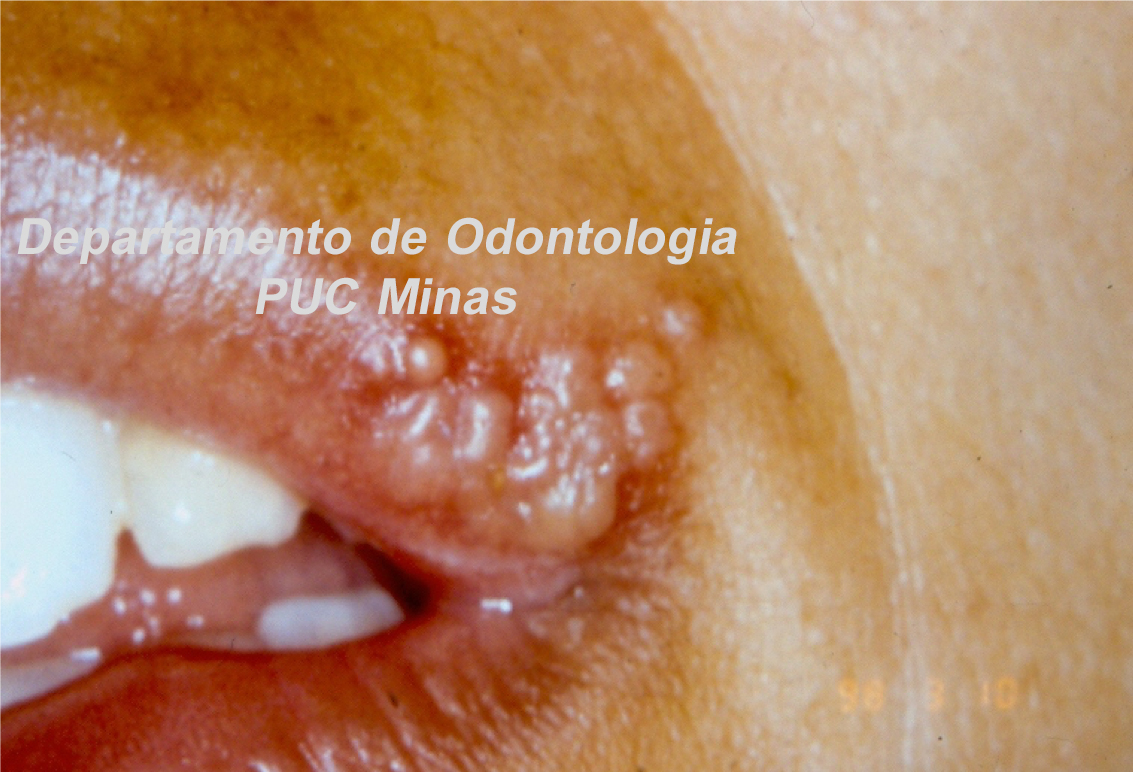
O padrão ouro de diagnóstico para a Síndrome de Sjögren é a análise histopatológica de glândulas salivares menores a partir de biópsia realizada no lábio inferior (Stefanski et al., 2017; Visser et al., 2020; Jiang et al., 2021). Na qual deve ser coletado cinco amostras nessa região (Figura 2).

Figura 2: Biópsia de glândula salivar menor na mucosa do lábio inferior. A: visualização das glândulas salivares menores imediatamente após a incisão; B: aspecto da glândula salivar menor imediatamente após a biópsia e antes de ser colocada no formaldeído a 10%. C; sutura do lábio inferior após a realização de biópsia. Fonte da imagem: Arquivos do Departamento de Odontologia da PUC Minas.
Histologicamente se observa fragmentos de glândulas salivares menores exibindo infiltrados inflamatório linfocitários focal sendo necessário mais de um foco por campo, com mais de cinquenta células. O infiltrado inflamatório, principalmente periductal, podendo haver uma necrose acinar e uma substituição lipídica (Stefanski et al., 2017; Visser et al., 2020; Jiang et al., 2021).
MANIFESTAÇÕES BUCAIS
Especialmente devido a xerostomia e a redução do fluxo salivar, o paciente com Síndrome de Sjögren, tem uma maior chance de apresentar cáries e queixas de dificuldades de deglutição de alimentos sólidos. Manifestações orais como ulcerações aftosas, úlceras traumáticas, candidíase e aumento do volume da glândula parótida (podendo levar a parotidite) também podem ser observados (Bowman, 2018; Mavragani et al., 2006).
TRATAMENTO
O tratamento da Síndrome de Sjögren é baseado no controle dos sintomas por meio de tratamentos paliativos realizados por uma equipe multidisciplinar. Isso traz uma melhoria na qualidade de vida desses pacientes. O tratamento é decidido individualmente de acordo com a atividade da doença e com a presença ou não, de manifestações clínicas (Stefanski et al., 2017; Cartee et al., 2015; Vitali et al., 2021).
Para a xeroftalmia é indicado o uso de lagrima artificial ou seus substitutos para obtenção da lubrificação e reduzir a chance de ceratoconjuntivite seca e complicações dessa (Stefanski et al., 2017).
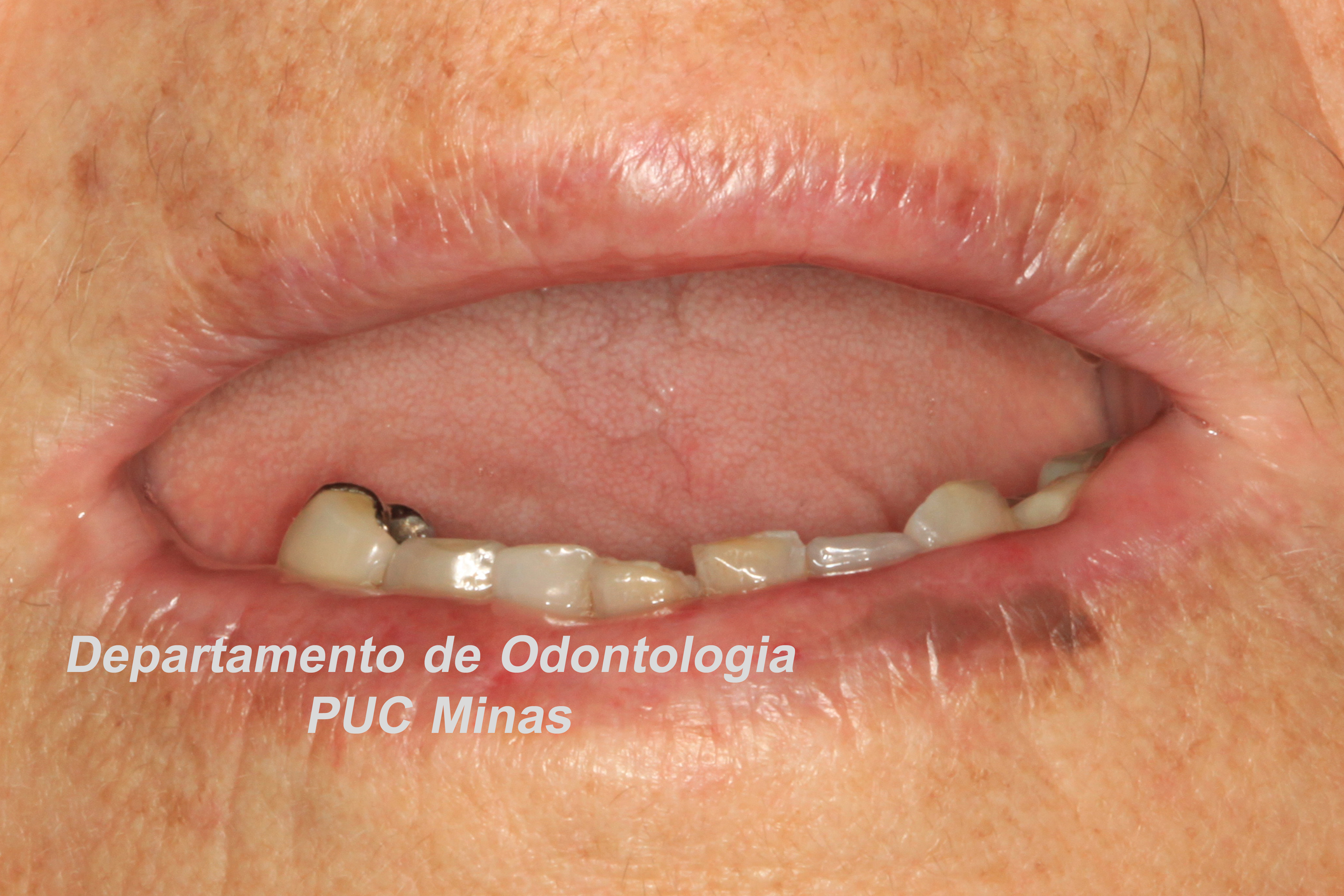
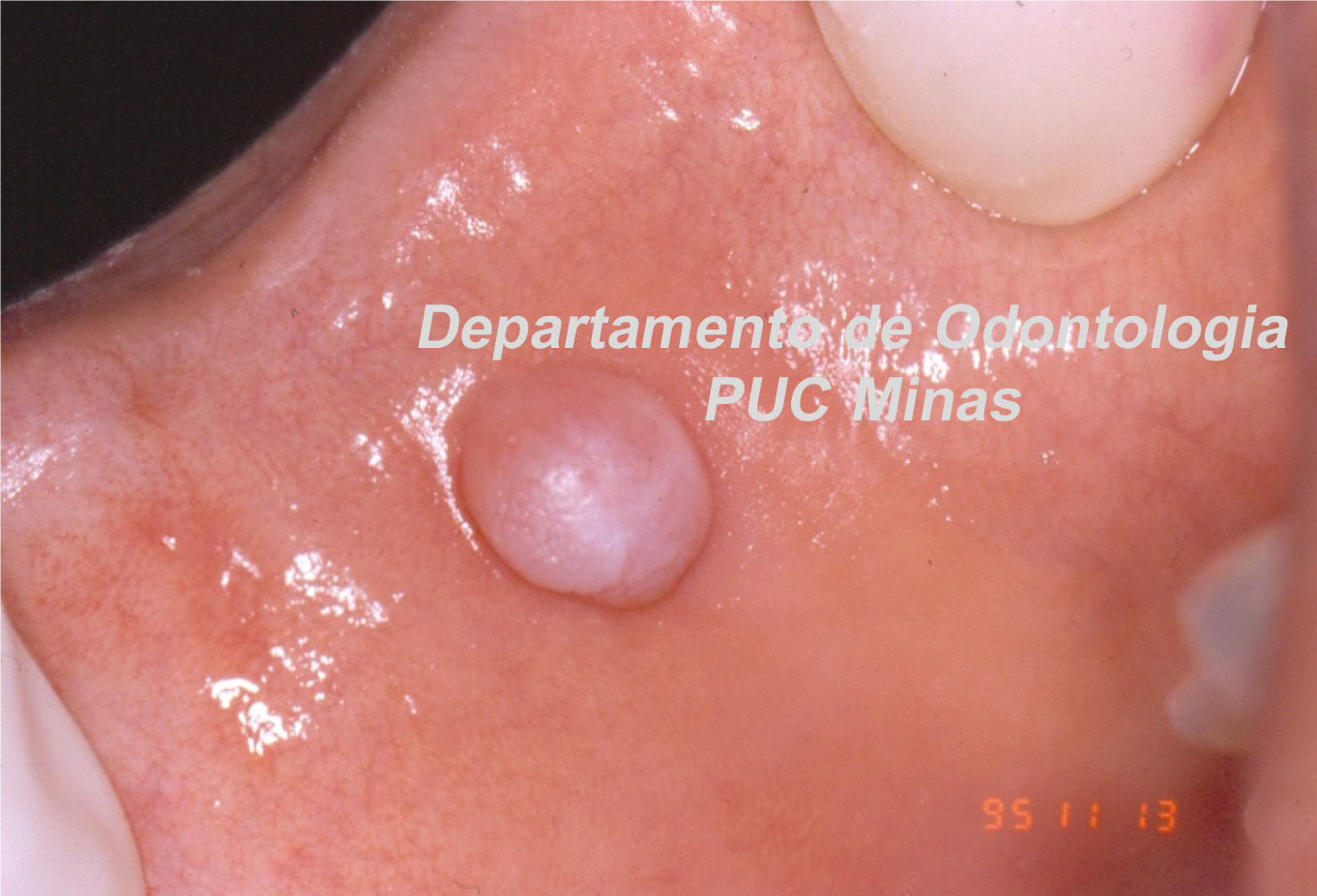
Para redução dos sintomas associados a xerostomia, orienta-se o uso de saliva artificial (Figura 3) e gomas de mascar sem açúcar. A terapia de fotobiomodulação com laser de baixa potência é uma outra opção de tratamento. Os efeitos benéficos dessa sobre a função das glândulas salivares, leva a redução da sensação de xerostomia e a melhoria do fluxo salivar, reduzindo a hipossalivação (Golež et al., 2021; Fidelix et al., 2018).
A aplicação de flúor deve ser recomendada como forma de prevenção para o desenvolvimento de lesões cariosas. O uso de antifúngicos para o tratamento de candidíase oral quando presente, também é recomendado (Stefanski et al., 2017; Cartee et al., 2015).

Figura 3: Saliva artificial em gel. Fonte da Imagem: Arquivos do Departamento de Odontologia da PUC Minas.
No geral, o prognóstico de pacientes com Síndrome de Sjögren é favorável, embora possam apresentar uma alteração na qualidade de vida (Golež et al., 2021; Cartee et al., 2015).
Considerando os aspectos clínicos e os sintomas dos pacientes com Síndrome de Sjögren, e o fato do tratamento ser multidisciplinar, torna-se evidentemente importante o papel do Cirurgião-Dentista na contribuição da melhoria da qualidade de vida desses pacientes (Stefanski et al., 2017; Cartee et al., 2015).
Uma complicação importante da Síndrome de Sjögren é a possibilidade de desenvolvimento de linfoma de células B do tecido linfoide associado a mucosa, particularmente nas glândulas salivares. Esse linfoma é caracteristicamente associado a lesões linfoepiteliais. As células B neoplásicas podem ser derivadas de células B intraductais glandulares não neoplásicas. Uma característica desse linfoma é a produção de fatores reumatoides (Thorne et al., 2017; Vitali et al., 2021).
REFERÊNCIAS
- Bowman SJ. Primary Sjögren’s syndrome. Lupus. 2018 Oct;27(1_suppl):32-35. doi: 10.1177/0961203318801673. PMID: 30452329.
- Cartee DL, Maker S, Dalonges D, Manski MC. Sjögren’s Syndrome: Oral Manifestations and Treatment, a Dental Perspective. J Dent Hyg. 2015 Dec;89(6):365-71. PMID: 26684993.
- Fidelix T, Czapkowski A, Azjen S, Andriolo A, Neto PH, Trevisani V. Low-level laser therapy for xerostomia in primary Sjögren’s syndrome: a randomized trial. Clin Rheumatol. 2018 Mar;37(3):729-736. doi: 10.1007/s10067-017-3898-9. Epub 2017 Nov 9. PMID: 29119483.
- Golež A, Frangež I, Cankar K, Frangež HB, Ovsenik M, Nemeth L. Effects of low-level light therapy on xerostomia related to hyposalivation: a systematic review and meta-analysis of clinical trials. Lasers Med Sci. 2021 Aug 19. doi: 10.1007/s10103-021-03392-0. Epub ahead of print. PMID: 34409539.
- Jiang Y, Zhao X, Yu J, Wang Q, Wen C, Huang L. Deciphering potential pharmacological mechanism of Sha-Shen-Mai-Dong decoction on primary Sjogren’s syndrome. BMC Complement Med Ther. 2021 Mar 1;21(1):79. doi: 10.1186/s12906-021-03257-7. PMID: 33648502; PMCID: PMC7923330.
- Mavragani CP, Moutsopoulos NM, Moutsopoulos HM. The management of Sjögren’s syndrome. Nat Clin Pract Rheumatol. 2006 May;2(5):252-61. doi: 10.1038/ncprheum0165. PMID: 16932698.
- Stefanski AL, Tomiak C, Pleyer U, Dietrich T, Burmester GR, Dörner T. The Diagnosis and Treatment of Sjögren’s Syndrome. Dtsch Arztebl Int. 2017 May 26;114(20):354-361. doi: 10.3238/arztebl.2017.0354. PMID: 28610655; PMCID: PMC5471601.
- Thorne I, Sutcliffe N. Sjögren’s syndrome. Br J Hosp Med (Lond). 2017 Aug 2;78(8):438-442. doi: 10.12968/hmed.2017.78.8.438. PMID: 28783408.
- Vitali C, Minniti A, Pignataro F, Maglione W, Del Papa N. Management of Sjögren’s Syndrome: Present Issues and Future Perspectives. Front Med (Lausanne). 2021 Jun 7;8:676885. doi: 10.3389/fmed.2021.676885. PMID: 34164418; PMCID: PMC8215198.
- Visser A, Verstappen GM, van der Vegt B, Vissink A, Bende RJ, Bootsma H, Bos NA, Kroese FGM. Repertoire Analysis of B-Cells Located in Striated Ducts of Salivary Glands of Patients With Sjögren’s Syndrome. Front Immunol. 2020 Jul 14;11:1486. doi: 10.3389/fimmu.2020.01486. PMID: 32760405; PMCID: PMC7372116.